
����Ŀ������������ʾ���ʱ仯�Ļ�ѧ����������( )��
A.����ȼ�ϵ���ڼ��Խ����е�������Ӧʽ��O2 + 2H2O + 4e��= 4 OH��
B.�ö��Ե缫��ⱥ���Ȼ�����Һ�����ӷ���ʽΪ��2C1һ+ 2H2O = H2��+ Cl2��+ 2OH��
C.���������绯ѧ��ʴ�ĸ�����Ӧʽ��Fe - 3e�� = Fe3+
D.��ͭ����ʱ�����Դ�����������Ǵ�ͭ���缫��ӦʽΪ��Cu2+ + 2e��= Cu
���𰸡�C
��������
A. ����������������ԭ��Ӧ������ȼ�ϵ���ڼ��Խ����е�������Ӧʽ��O2 + 2H2O + 4e��= 4 OH������A��ȷ��
B. �ö��Ե缫��ⱥ���Ȼ�����Һ�����������ơ����������������ӷ���ʽΪ��2C1һ+ 2H2O ![]() H2��+ Cl2��+ 2OH������B��ȷ��
H2��+ Cl2��+ 2OH������B��ȷ��
C. ���������绯ѧ��ʴ���������Σ�������Ӧʽ��Fe - 2e�� = Fe2+����C����
D. ��ͭ����ʱ����ͭ�������������������Դ�����������Ǵ�ͭ�������ĵ缫��ӦʽΪ��Cu2+ + 2e��= Cu����D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѳ������л���Ӧ���ܼ���ʵ�����Ʊ������ѵķ�Ӧ����Ҫʵ��װ�����£�2CH3CH2CH2CH2OH![]() ��CH3CH2CH2CH2��2O+H2O����Ӧ��Ͳ��������������±���
��CH3CH2CH2CH2��2O+H2O����Ӧ��Ͳ��������������±���
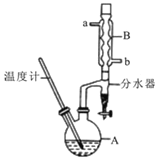

�ٽ�6 mLŨ�����37 g����������һ��˳�����ӵ�A�У����Ӽ�����ʯ��
�ڼ���A�з�ӦҺ��Ѹ��������135�棬ά�ַ�Ӧһ��ʱ�䡣
�۷����ᴿ����A��Һ����ȴ���仺������ʢ��70 mLˮ���¶ȷ�Һ©���У���ҡ���ã���Һ�ôֲ��
�ֲܴ���������40 mLˮ��20 mL NaOH��Һ��40 mLˮϴ�ӣ���Һ�����Լ3g��ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ơ�
�ݽ������������Ĵֲ�����������ռ���֣��ô���������11g����ش�
��1���������Ũ�����������������˳��Ϊ��Ӧ�ȼ� ��
��2������Aǰ�����ȴ� ���a����b��������B��ͨ��ˮ��
��3������۵�Ŀ���dz���ϴȥ ����ҡ���ã��ֲ���Ӧ ����ϡ����¡����ڵ�����
��4��������У���������ʱӦ�ռ� ����ѡ����ĸ�����ҵ���֡�
A��100�� B��117�� C��135�� D��142��
��5����Ӧ�����л�۲쵽��ˮ�����ռ���Һ�����ʣ��ҷ�Ϊ�������㣬���ŷ�Ӧ�Ľ��У���ˮ����Һ��������������ʱ���ϲ�Һ�������֧���Զ�����A����ˮ�����ϲ�Һ�����Ҫ�ɷ�Ϊ ���²�Һ�����Ҫ�ɷ�Ϊ ��
��6����ʵ���У������ѵIJ���Ϊ ����ȷ��1%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�Ӧ��������˵����ȷ����
A.Zn(s)+CuSO4(aq)![]() ZnSO4(aq)+Cu(s) ��H=216 kJ/mol��E��Ӧ��<E������
ZnSO4(aq)+Cu(s) ��H=216 kJ/mol��E��Ӧ��<E������
B.CaCO3(s)![]() CaO(s)+CO2(g) ��H=+178.2 kJ/mol��E��Ӧ��<E������
CaO(s)+CO2(g) ��H=+178.2 kJ/mol��E��Ӧ��<E������
C.HCl(g)![]()
![]() H2(g)+
H2(g)+![]() Cl2(g) ��H=+92.3 kJ/mol��1 mol HCl���ܱ������зֽ��ų�92.3 kJ������
Cl2(g) ��H=+92.3 kJ/mol��1 mol HCl���ܱ������зֽ��ų�92.3 kJ������
D.H+(aq)+OH(aq)![]() H2O(l) ��H=57.3 kJ/mol����1 mol NaOH���ռ���Һ�뺬0.5 mol H2SO4��ŨH2SO4��Ϻ�ų�57.3 kJ������
H2O(l) ��H=57.3 kJ/mol����1 mol NaOH���ռ���Һ�뺬0.5 mol H2SO4��ŨH2SO4��Ϻ�ų�57.3 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д��������̣�����һ���¶��µ��ܱ������д������·�Ӧ��2SO2(g) + O2(g)![]() 2SO3(g)����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
2SO3(g)����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
��1����SO2ת����Ϊ50��ʱ���÷�Ӧ�Ƿ�ﵽƽ��״̬��________����δ�ﵽ���ĸ�������У�__________
��2����ƽ��״̬ʱ�� SO2��ת����ӦΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ���������������������������ȷ�ģ� ��
ѡ�� | ʵ����������� | ���� |
A | ���������������ש���������ȡ����ȡҺ��ʹKMnO4��Һ��ɫ | ��ȡҺ�к�Fe2+ |
B | �����£���ñ���Na2CO3 ��Һ��pH���ڱ���NaHCO3 ��Һ��pH | ������ˮ��̶� |
C | 25��ʱ����AgNO3��Һ�еμ�����NaCl��Һ�����ٲ���������Ȼ��μ�KI��Һ���л�ɫ�������� | 25��ʱ��Ksp��AgCl��>Ksp��AgI�� |
D | ��Cl2ͨ����з�̪��NaOH��Һ����Һ��ɫ | Cl2����Ư���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ����ͼ��ʾ������˵���У��������( )��

A.ȼ�ϵ����ͨ������һ�˵Ķ�缫Ϊ����
B.ȼ�ϵ�ع���ʱ��������ӦΪ��O2 + 2H2O + 4e��= 4 OH��
C.��ȼ�ϵ�ص��ܷ�ӦʽΪ��2H2+O2=2H2O
D.��װ�ÿ�ʵ�ֽ�����ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��װ�ý���ʵ��(�г�������ȥ)������a��b��c�зֱ�ʢ���Լ�1��2��3,�ܴﵽʵ��Ŀ�ĵ���
ѡ�� | �Լ�1 | �Լ�2 | �Լ�3 | ʵ��Ŀ�� | װ�� |
A | Ũ���� | MnO2 | ����NaCl��Һ | �Ʊ�������Cl2 |
|
B | Ũ HNO3 | CuƬ | KI--������Һ | ��֤NO2�������� | |
C | ϡ���� | ��ҺX | �Μ[ʯ��ˮ | ��֤X���Ƿ���CO32- | |
D | ϡ���� | FeS | ����KMnO4��Һ | ��֤H2S���л�ԭ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö�������(ClO2)���Ʊ���;�㷺����������(NaClO2)��ʵ���ҿ�������װ��(��ȥ���ּг�����)�Ʊ��������������ơ�
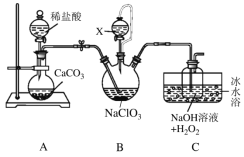
��֪����ClO2�е�Ϊ9.9�棬������ˮ���ж���Ũ�Ƚϸ�ʱ������ը��
��NaClO2������Һ����38��ʱ����NaClO23H2O������38��ʱ����NaClO2������60��ʱNaClO2�ֽ�ΪNaClO3��NaCl��
��Bװ��ΪClO2����װ�ã������Լ�NaClO3��H2SO4(Ũ)��CH3OH��
��ش��������⣺
(1)װ��B���Լ�X������Ϊ___________��ʢ�Ÿ��Լ�������������Ϊ________________��
(2)ʵ������������ͨ��һ������CO2����Ŀ����______________����Ӧ����������ͨ��һ������CO2����Ŀ����_____________________��
(3)װ��C�е�ˮԡ�¶�Ӧ������____________________(���¶ȷ�Χ)��װ��C������NaClO2�����ӷ���ʽΪ___________________��
(4)����װ�ô���һ�����Ե�ȱ�ݣ���Ľ���ʩΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Calanolide A��һ�ֿ�HIVҩ���ṹ��ʽ��ͼ��ʾ�����й���Calanolide A��˵��������ǣ� ��

A. ��������3������̼ԭ��
B. ��������3�ֺ���������
C. �����ʼȿɷ�����ȥ��Ӧ�ֿɷ����ӳɷ�Ӧ
D. 1mol������������NaOH��Һ��Ӧʱ����1molNaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com