
【题目】下列分离或提纯有机物的方法正确的是( )
选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
A | 乙烷 | 乙烯 | 酸性 KMnO4溶液, 洗气 |
B | 溴苯 | 溴 | NaOH 溶液,分液 |
C | 乙酸 | 乙醇 | 金属钠,蒸馏 |
D | 乙醇 | 水 | 生石灰,过滤 |
A. A B. B C. C D. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了 1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g) ![]() 2NH3(g) △H=________ kJ/mol
2NH3(g) △H=________ kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H2 0 .5mol,在一定温度下进行反应:N2(g)+3H2(g) ![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是______________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入0.9mol N2,则平衡将____(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1 mol N2和3 molH2组成的混合气体,发生反应N2(g)+3H2(g) ![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________

a.A、 B、 C三点的平衡常数大小关系:KA<KB<KC
b.B点和C点的H2浓度大小关系:B<C
c.A点和B点混合气体的密度大小关系:A<B
d.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:

①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)=2H2O(g) Δ H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2 (g)+4H2O(g) Δ H2=-1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用图一装置进行实验,试回答下列问题。

(1)① 若开始时开关K与a连接,则铁发生的是电化学腐蚀中的_______腐蚀;
② 若开始时开关K与b连接,则总反应的离子方程式____________________。
(2)用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
① 该电解槽的阳极反应式为:_______________
② 制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”)___________导出。
③ 若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为________________。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有_________kJ的能量转化为电能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作合理的是
A. 用乙醇萃取碘水中的碘
B. 用金属钠检验无水乙醇中是否含有水
C. 做银镜反应后试管壁上银镜,用稀氨水洗涤
D. 盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是

A.三种酸的电离常数关系: KHA>KHB>KHD
B.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按物质的组成进行分类,HNO3应属于( )
①酸 ②氧化物 ③含氧酸 ④一元酸 ⑤化合物
A. ①②③④⑤ B. ①③⑤ C. ①②③⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体。25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出)。下列说法不正确的是( )
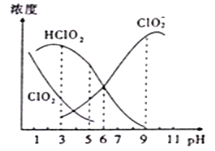
A.25℃时, ClO2-的水解平衡常数Ka=10-6
B.在pH约为4.0~4.5范围内使用该漂白剂较好
C.25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:
c(HClO2)+c(H+)+c(Na+)=c(ClO2-)+2c(OH-)
D.当pH=5时往NaClO2溶液中滴入稀氢氧化钠溶液,溶液中主要反应的离子方程式是:HClO2+OH-=H2O+ClO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如下图所示。下列说法错误的是

A. X元素的原子序数是19
B. Xn+中n=1
C. 该晶体中阳离子与阴离子个数比为3∶1
D. 晶体中每个N3-周围有6个等距离且最近的Xn+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com