
����Ŀ��ij��ѧ��ȤС����̽���������ʵ����ʼ��Ʊ���
��̽��һ��ѡ�������װ�ú�ҩƷ̽��������������������ǿ����
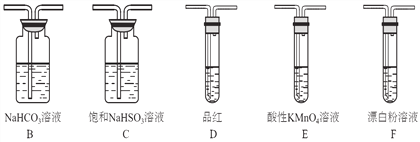
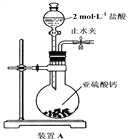
��1��װ��A��ʢҺ��IJ�������������____________��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ________________________________��
��2��װ������˳��ΪA��C��_______��_______��D��F������װ��C��������_________��ͨ������_________________________________������֤�������������ǿ�ڴ����ᡣ
��̽�����������������ƣ�Na2S2O4���׳Ʊ��շۣ��㷺���ڷ�֯��ҵ�Ļ�ԭ��Ⱦɫ����ϴ��ӡ������ɫ�Լ�֯���Ư�ȡ���ȡ���շ�ͨ����Ҫ��������
��3����ȡNa2S2O4���ü����Ʒ��������¶�70-80�棬�ڼ״���Һ���ܼ������ܽ�����ƣ�HCOONa�����ٵμ�Na2CO3��ҺͬʱͨSO2ά����Һ���ԣ���������Na2S2O4���÷�Ӧ�����ӷ���ʽ_________________________________��
��4���ⶨ���շ۴��ȡ�Na2S2O4����ǿ��ԭ������¶�ڿ������ױ�����������Na2S2O4��KMnO4������Һ������Ӧ��5Na2S2O4+6KMnO4+4H2SO4�T5Na2SO4+3K2SO4+6MnSO4+4H2O����ȡ5.0gNa2S2O4��Ʒ������ˮ�У����100mL��Һ��ȡ��10mL����Һ����ƿ�У���0.10molL��1��KMnO4��Һ�ζ����ظ���������2�Σ�ƽ������KMnO4��Һ21.00mL�������Ʒ��Na2S2O4����������Ϊ_______________�����ʲ����뷴Ӧ����
���𰸡� ��Һ©�� CaSO3+2HCl=CaCl2+SO2��+H2O B E ��ȥHCl���� װ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ���� 2HCOO-+4SO2+CO32-=2S2O42-+H2O+3CO2 60.9%
����������1����װ��A֪ʢҺ��IJ������������Ƿ�Һ©����װ��A�з�Һ©����ʢ��Һ��Ϊ���ᣬ��ƿ��װ����CaSO3���������߿��Է�����Ӧ������CaCl2�Ͷ�������ˮ����Ӧ�Ļ�ѧ��Ӧ����ʽΪCaSO3+2HCl=CaCl2 +SO2��+H2O��
(2)װ��A�Ʊ�SO2�����ڴ������ξ���ǿ�����ԣ���˸��ݽ�ǿ���Ʊ�������֪����SO2ͨ��̼��������Һ�У������CO2���壬���������Ը��������Һ��ȥ��������е�SO2������Ʒ����Һ�����Ƿ����������CO2ͨ��Ư����Һ�м���ʵ��������������������ǿ���Ƚϣ�����װ������˳��ΪACBEDF������װ��C�������dz�ȥHCl���塣ͨ������װ��D��Ʒ����Һ����ɫ��˵��SO2�Ѿ�������CO2��F�е�Ư����Һ������Ӧ������̼��ư�ɫ������˵��̼������Աȴ�����ǿ��������������ֱ�̼��ǿ������װ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ����������֤�������������ǿ�ڴ����ᡣ�𰸣� B.Eװ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ������
3��1������ԭ���غ�͵��ӵ�ʧ�غ��֪��Ӧ�����ӷ���ʽΪ2HCOO-+4SO2+CO32-=2S2O42-+H2O+3CO2��
��2�����ĸ�����ص����ʵ�����0.0021mol�����ݷ���ʽ��֪����Na2S2O4�����ʵ�����0.0021mol��5/6=0.00175mol�����ԭNa2S2O4�����ʵ�����0.0175mol�������Ʒ��Na2S2O4����������Ϊ![]() ��
��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�H2A��һ��������ˮ�Ķ�Ԫ�ᣬ��NaOH��Һ��������ʵ���Ũ�ȵ�H2A��Һ�У���Һ��H2A��HA-��A2-�����ʵ�����������ҺpH�ı仯��ϵ��ͼ��ʾ������˵��������ǣ� ��

A. �����£�H2A�ĵ���ƽ�ⳣ�� Ka1=10-3.30
B. �� c(Na+)=2c(A2-)+c(HA-)ʱ����Һ������
C. pH=6.27ʱ��c(A2-)=c(HA-)��c(H+)��c(OH-)
D. V(NaOH��Һ)��V(H2A��Һ)=3��2 ʱ��2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���Լױ�Ϊ��Ҫԭ�ϣ���������·�ߺϳ�ҽҩ�м���F��Y�� 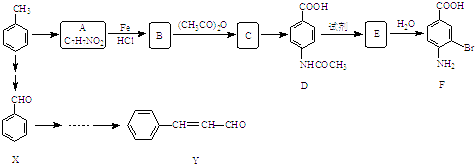
��֪�� ![]()
![]()
![]() ��2CH3CHO
��2CH3CHO ![]()
![]()
��ش��������⣺
��1�������й�F��˵����ȷ���� ��
A.����ʽ��C7H7NO2Br
B.�������
C.�ܷ���ȡ����Ӧ�����۷�Ӧ
D.1mol��F�����Ժ�2mol NaOH��Ӧ
��2��C��D�ķ�Ӧ������ ��
��3��B��C�Ļ�ѧ����ʽ�� �� �ںϳ�F�Ĺ����У�B��C���費��ʡ�ԣ������� ��
��4��д��ͬʱ��������������A��ͬ���칹��Ľṹ��ʽ �� ��Ҫ��д��3�֣� �ٱ�����ֻ�����ֲ�ͬ��ѧ��������ԭ�ӣ� �ڷ����к��� ![]() ��
��
��5����X����ϩΪԭ�Ͽɺϳ�Y������ƺϳ�·�ߣ����Լ����ܼ���ѡ���� ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
CH3CHO ![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3 �� ��
CH3COOCH2CH3 �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������0.1molL��1������Һ��pH=a��������ʹ��ҺpH=��a+1���Ĵ�ʩ�ǣ�������
A.����Һϡ�͵�ԭ�����10��
B.���������Ĵ����ƹ���
C.��������0.2 molL��1����
D.�����Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��ԭ��������x��B2-��A3+������ͬ�ĵ��Ӳ�ṹ����BԪ�ص�ԭ������Ϊ( )
A. x-5 B. x+5 C. x+1 D. x-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ���Ũ��Ϊ0.100 0molL��1������ⶨδ֪���ʵ���Ũ�ȵ�����������Һ��ѡ���̪��ָʾ��������д���пհף�
��1���ñ�������ζ����������������Һʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ��ֱ�������һ�����ᣬ��Һ �� ����ֹͣ�ζ���
��2�����в����п���ʹ��������������Һ��Ũ����ֵƫ�͵���������ţ���
A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B.�ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
E.�ζ������У���ƿ�����ڼ��ң�ʹ������Һ����
��3����ij�εζ�����ʱ����ʽ�ζ����е�Һ����ͼ��ʾ��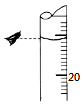
�����Ϊ mL�������ӣ���ʹ����ƫ�����С������
��4���ٽ�ϱ����ݣ����㱻������������Һ�����ʵ���Ũ���� molL��1 ��
�ζ� | ������Һ | ������� | |
�ζ�ǰ�Ŀ̶�/mL | �ζ���Ŀ̶�/mL | ||
��һ�� | 10.00 | 1.34 | 19.39 |
�ڶ��� | 10.00 | 4.10 | 21.10 |
������ | 10.00 | 0.40 | 17.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ���绯ѧԭ�����������γ�����Ĥ������俹��ʴ����������ԭ����ͼ��ʾ������˵������ȷ����

A. ̼������ͭ�����棬�������Ǵ��ݵ���
B. ͨ��һ��ʱ�����Һ��pH��С
C. ͨ�����ӱ�ǿ�ƴ�̼��������Ƭʹ�������γ�����Ĥ
D. ��ͨ�����ڻ�������������������Ĥ���γ��ٶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH4I�����ܱ������У���һ���¶��·������з�Ӧ����NH4I(s)![]() NH3(g)��HI(g)����2HI(g)
NH3(g)��HI(g)����2HI(g) ![]() H2(g)��I2(g)�ﵽƽ��ʱ��c(H2)��1 mol��L��1��c(HI)��4 mol��L��1������¶��·�Ӧ�ٵ�ƽ�ⳣ��Ϊ( )
H2(g)��I2(g)�ﵽƽ��ʱ��c(H2)��1 mol��L��1��c(HI)��4 mol��L��1������¶��·�Ӧ�ٵ�ƽ�ⳣ��Ϊ( )
A. 36 B. 24 C. 16 D. 9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���AΪԭ�Ͽ��Ժϳ�ҩ��SERMs���м���E����ϳ�·��������

�ش�����������
��1��A�Ļ�ѧ����Ϊ_________��E�й����ŵ�����Ϊ________________��
��2��A��B�ķ�Ӧ����Ϊ________��B��C�ķ�Ӧ����Ϊ________________��
��3��B�Ľṹ��ʽΪ_________________��
��4����D����E�Ļ�ѧ����ʽΪ__________________��
��5����ȡ�������廯����W��E��ͬ���칹������������������W����___��(���������칹)��
��1molW��������������Һ����������Ӧ����4molAg
������FeCl3��Һ������ɫ��Ӧ
���к˴Ź�������Ϊ�����Ľṹ��ʽΪ_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com