
【题目】A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:
①A++C-![]() D+E↑;②B++C-===2D。
D+E↑;②B++C-===2D。
请回答:
(1)C-离子的电子式是________________。
(2)A+离子中的键角为______________。
(3)分别写出A+和D反应、B+和E反应的离子方程式____________、____________。
(4)除D、E外,请再写出两种含10个电子的分子的分子式____________。
(5)除A+、B+外,请再写出两种含10个电子的阳离子________。
【答案】![]() 109.5° NH4++H2O
109.5° NH4++H2O![]() NH3·H2O+H+ H3O++NH3=NH4++H2O CH4、Ne Na+、Mg2+
NH3·H2O+H+ H3O++NH3=NH4++H2O CH4、Ne Na+、Mg2+
【解析】
10电子微粒有:H2O、NH3、CH4、HF、NH4+、H3O+、OH-、Al3+、Na+、Mg2+、O2-、F-等;
根据:A++C-![]() D+E↑;②B++C-===2D可知A+为NH4+、B+为H3O+、C-为OH-、D为H2O、E为NH3,据此解答。
D+E↑;②B++C-===2D可知A+为NH4+、B+为H3O+、C-为OH-、D为H2O、E为NH3,据此解答。
(1)根据上述分析,C-的电子式为![]() ,
,
故答案为:![]() ;
;
(2)NH4+离子中的键角为109.5°,
故答案为:109.5°;
(3)A+和D反应的离子方程式为NH4++H2O![]() NH3·H2O+H+,B+和E反应的离子方程式H3O++NH3=NH4++H2O,
NH3·H2O+H+,B+和E反应的离子方程式H3O++NH3=NH4++H2O,
故答案为:NH4++H2O![]() NH3·H2O+H+;H3O++NH3=NH4++H2O;
NH3·H2O+H+;H3O++NH3=NH4++H2O;
(4)除H2O、NH3外,另外两种含10个电子的分子有:CH4、Ne、HF等,
故答案为:CH4、Ne;
(5)除NH4+,H3O+外,另外两种含10个电子的阳离子有:Na+、Mg2+、Al3+等,
故答案为:Na+、Mg2+。


科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。如图是元素周期表的一部分,表中所列序号①、②、③、④、⑤、⑥、⑦、⑧分别代表某种化学元素。根据表格所给信息,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ④ | ⑧ | |||
(1)8种元素中,性质最稳定的是___(填元素符号)。
(2)①与④可形成___化合物(填“共价”、“离子”),其电子式为___。
(3)原子半径②___③,①___⑤(填“>”、“<”或“=”)。
(4)在元素⑤、⑥、⑦中,金属性最强的元素是___。(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2 和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式:________。
(2)①室温下,0.1 mol·L–1 NaClO溶液的pH___ 0.1 mol·L–1 Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)已知:H2SO3的Ka1=1.54×10–2,Ka2=1.02×10–7;HClO的Ka=2.95×10–8
②写出一种可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法:____
(3)氯气含量检测仪中,原电池工作原理示意图如图所示,则Cl2在Pt电极放电的电极反应为_____
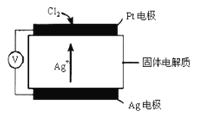
(4)工业上用NaClO3氧化酸性FeCl2废液,通过控制条件,使Fe3+水解产物聚合,形成可溶的多聚体,最终析出红棕色胶状沉淀Fe2O3·nH2O。其中水解形成羟桥配离子的离子方程式为:2Fe3++10H2O ![]() [Fe(H2O)4 (OH)2 Fe(H2O)4]4++2H+ 。欲使上述水解平衡正向移动,可采用的方法有________(填字母)。
[Fe(H2O)4 (OH)2 Fe(H2O)4]4++2H+ 。欲使上述水解平衡正向移动,可采用的方法有________(填字母)。
A.加水稀释 B.加热 C.加入盐酸 D.加入NaHCO3
(5)ClO2和Cl2均能将电镀废水中的CN– 氧化为无毒的物质,自身被还原为Cl–。处理含CN–相同量的电镀废水,所需Cl2的质量是ClO2的______ 倍。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气可反应制得氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。用图示装置制备氮化钡时,下列说法不正确的是( )
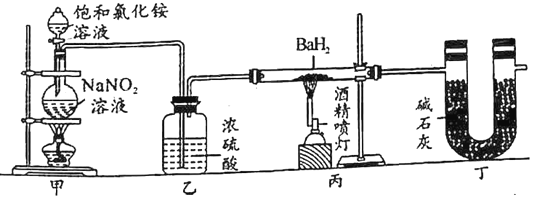
A.装置甲中反应的化学方程式为NaNO2+NH4Cl![]() N2↑+NaCl+2H2O
N2↑+NaCl+2H2O
B.BaH2遇水反应,H2O作还原剂
C.实验时,先点燃装置甲中的酒精灯,反应一段时间后,再点燃装置丙中的酒精喷灯进行反应
D.装置乙中的浓硫酸和装置丁中的碱石灰均是用于吸收水蒸气,防止水蒸气进入装置丙中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①CH4 ②CH3CH2OH ③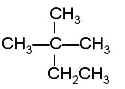 ④癸烷 ⑤CH3COOH ⑥
④癸烷 ⑤CH3COOH ⑥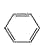 ⑦
⑦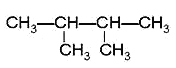 ⑧
⑧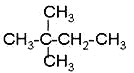 ⑨丙烷
⑨丙烷
请根据上述给出的物质按要求回答下列问题:
(1)分子中含有14个氢原子的烷烃的分子式是____;
(2)与③互为同分异构体的是_____(填序号);
(3)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是____(填序号);它与⑧互为_____关系;
(4)相对分子质量为44的烷烃的结构简式为______;
(5)用“>”表示①③④⑨熔沸点高低顺序:______(填序号);
(6)具有特殊气味,常作萃取剂的有机物在铁作催化剂的条件下与液溴发生一取代反应的化学方程式_____;
(7)有机物②在加热条件下和CuO反应的化学方程式_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
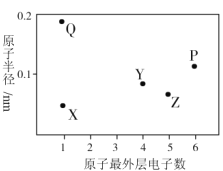
A.Q与氧形成的某化合物中可能含有离子键和非极性键
B.最高价氧化物对应水化物的酸性:Z<Y
C.P的最低价氢化物水溶液久置于空气中会产生浑浊
D.简单离子半径大小为:P>Z>Q>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位置、结构和性质的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
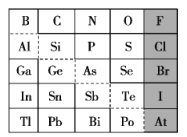
(1)Sn的最高价氧化物对应水化物的化学式为___,N、O、F对应的简单离子的半径由大到小的顺序为___。(写离子符号)
(2)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___。(写化学式)
②H3AsO4、H2SeO4的酸性强弱:H3AsO4(填“>”“<”或“=”)___ H2SeO4。
③镓的氯化物与氨水反应的化学方程式为___。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2A1+4BaO![]() 3Ba↑+BaOA12O3
3Ba↑+BaOA12O3
利用上述方法可制取Ba的主要原因是(________)
a.高温时A1的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaOA12O3比Al2O3稳定
d.Ba的沸点比A1的低
(4)用铝热法还原下列氧化物,制得金属各1mo1,消耗铝最少的是___。
a.MnO2 b.WO3 c.Cr2O3 d.Co3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
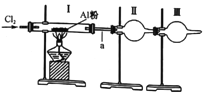
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的结构简式可用![]() 来表示,下列关于苯的叙述中正确的是
来表示,下列关于苯的叙述中正确的是
A. 苯主要是以石油为原料而获得的一种重要化工原料
B. 苯中含有碳碳双键,所以苯属于烯烃
C. 苯分子中6个碳碳化学键完全相同
D. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com