
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位置、结构和性质的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
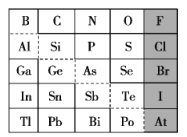
(1)Sn的最高价氧化物对应水化物的化学式为___,N、O、F对应的简单离子的半径由大到小的顺序为___。(写离子符号)
(2)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___。(写化学式)
②H3AsO4、H2SeO4的酸性强弱:H3AsO4(填“>”“<”或“=”)___ H2SeO4。
③镓的氯化物与氨水反应的化学方程式为___。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2A1+4BaO![]() 3Ba↑+BaOA12O3
3Ba↑+BaOA12O3
利用上述方法可制取Ba的主要原因是(________)
a.高温时A1的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaOA12O3比Al2O3稳定
d.Ba的沸点比A1的低
(4)用铝热法还原下列氧化物,制得金属各1mo1,消耗铝最少的是___。
a.MnO2 b.WO3 c.Cr2O3 d.Co3O4
【答案】H2SnO3或Sn(OH)4或H4SnO4 N3->O2->F- HF < GaC13+3NH3H2O=Ga(OH)3↓+3NH4C1 d d
【解析】
(1)根据周期表可知,Sn与C同主族,则Sn的最高正价为+4价,其最高价氧化物对应水化物的化学式为H2SnO3或Sn(OH)4或H4SnO4,N、O、F对应的简单离子的核外电子层数相同,核电荷数N<O<F,则离子半径N3->O2->F-;
(2)①同一主族元素自上而下非金属性依次减弱,非金属性越强,氢化物的稳定性越强,则阴影部分元素氢化物热稳定性最高的是HF;
②非金属性越强,最高价氧化为对应水化物的酸性越强,非金属性Se>As,则酸性H3AsO4<H2SeO4;
③镓的氯化物为GaCl3,与氨水反应生成氯化铵和Ga(OH)3,反应的化学方程式为GaC13+3NH3H2O=Ga(OH)3↓+3NH4C1;
(3)Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行,故选d;
(4)根据化合价的变化判断,化合价变化的数值越小,说明发生氧化还原反应时得到的电子数目越少,则消耗铝的量最少;
a.MnO2~Mn,生成1molMn,需要4mol电子,消耗![]() molAl;
molAl;
b.WO3~W,生成1molW,需要6mol电子,消耗2molAl;
c.Cr2O3~Cr,生成1molCr,需要3mol电子,消耗1molAl
d.Co3O4~Co,生成1molCo,需要![]() mol电子,消耗
mol电子,消耗![]() molAl;
molAl;
结合以上分析可知,消耗Al最少的是Co3O4,故答案选d。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]= 1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解常数为1.0×10-10。
B. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6mol·L-1
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2(s)+2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:烃的衍生物A的摩尔质量为32g·molˉ1,且能与金属钠反应。E的分子式为C3H6O2。有关物质的转化关系如图:

请回答:
(1)D中含有的官能团名称是__。
(2)写出有机物E与NaOH溶液反应的化学方程式__。
(3)下列说法正确的是_。
A.有机物C的水溶液常用于标本的防腐
B.有机物B、D都能与金属钠发生反应
C.有机物E中混有D,可用饱和碳酸钠溶液进行分离
D.有机物M为高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:
①A++C-![]() D+E↑;②B++C-===2D。
D+E↑;②B++C-===2D。
请回答:
(1)C-离子的电子式是________________。
(2)A+离子中的键角为______________。
(3)分别写出A+和D反应、B+和E反应的离子方程式____________、____________。
(4)除D、E外,请再写出两种含10个电子的分子的分子式____________。
(5)除A+、B+外,请再写出两种含10个电子的阳离子________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给某潜水器提供动力的电池如图所示。下列有关说法正确的是( )
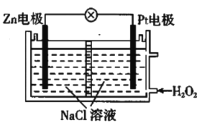
A.Zn极发生了还原反应
B.电池中的Na+向Zn电极移动
C.Pt电极反应式为H2O2+2e-=2OH-
D.电子从Zn电极沿导线流向Pt电极,再经溶液回到Zn电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2SO2(g)+O2(g)![]() 2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol/L则,0~10s内平均反应速率为
2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol/L则,0~10s内平均反应速率为
A. v(O2)=0.3mol.L-1.s-1B. v(O2)=0.03mol.L-1.s-1
C. v(SO2)=0.03mol.L-1.s-1D. v(SO3)=0.03mol.L-1.s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组做了如下实验探究海带中碘元素的存在形式,探究过程如图:

(1)操作I为灼烧,则灼烧时应该用___(仪器名称)盛装海带,操作II为___;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是___。
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO![]() 形式存在②以I-形式存在
形式存在②以I-形式存在
查阅资料:IO![]() 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
序号 | 实验操作 | 实验现象 | 结论 |
① | 取少量稀释后的溶液A加入淀粉后再 用硫酸酸化,分装于试管I、II | 无现象 | |
② | 往试管I中加入FeC12溶液,然后加入2滴KSCN溶液并振荡; | ___ | 证明不是以IO |
③ | 往试管II中加入___; | ____ | 证明以I-形式存在 |
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mo1/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO![]() 的还原产物为Mn2+,写出离子方程式___。
的还原产物为Mn2+,写出离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是________;不溶于水,且密度比水小的是________。
(2)一瓶无色气体,可能含有CH4和CH2=CH2或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐退去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确?________(填“正确”或“不正确”),理由是______________________。
②上述实验可能涉及的反应类型有_________________________。
(3)含有![]() 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合而成的,其化学方程式是________________________。
聚合而成的,其化学方程式是________________________。
②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯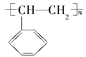 ,它是由________(写结构简式)聚合而成的。
,它是由________(写结构简式)聚合而成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】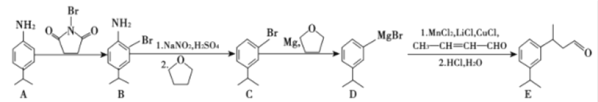
已知:CH3-CH=CH-CHO巴豆醛
回答下列问题:
(1)B物质所含官能团名称是________,E物质的分子式是_________
(2)巴豆醛的系统命名为____________,检验其中含有碳碳双键的方法是___________。
(3)A到B的反应类型是__________,E与足量氢气在一定条件下反应的化学方程式是_____。
(4)比A少两个碳原子且含苯环的同分异构体有________种,写出核磁共振氢谱有四组峰且峰面积比为3:2:2:2的结构简式______。
(5)已知:![]() +
+ ![]()
![]()
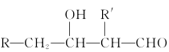 ,请设计由乙醇为原料制备巴豆醛的合成路线______。
,请设计由乙醇为原料制备巴豆醛的合成路线______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com