
【题目】把下列金属投入0.1 mol·L-1盐酸中,能发生反应且反应最剧烈的是( )
A. Cu B. Fe C. Mg D. Al
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示. 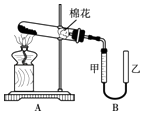
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 .
②据报道高锰酸钾受热分解不产生MnO2 , 已知产气率= ![]() ×100%.若只发生KMnO4
×100%.若只发生KMnO4 ![]() KMnO2+O2↑,则产气率为 .
KMnO2+O2↑,则产气率为 .
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8 , 写出分解产生这两种物质及氧气的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 钠保存在煤油里的原因之一是它极易与氧气反应
B. 铝在空气中很容易燃烧
C. 镁表面的氧化膜疏松,不能保护内层金属
D. 铁锈的主要成分是Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机物的分子式为C4H4 , 分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( ) 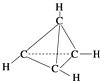
A.2 种
B.4种
C.5种
D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色.
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO; ③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O
(2)上述实验过程②与③中,I2起到了的作用.
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.Si的熔点高,可用作半导体材料
C.FeCl3溶液显酸性,可用于蚀刻铜制的电路板
D.漂白液中含有强氧化性物质,可作漂白剂和消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL 1mol / L NaOH溶液中,Na+的物质的量浓度为( )
A. 40g/mol B. 1.0mol/L C. 0.2mol D. 0.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量锌粉反应时,为了减缓反应速率但又不影响生成H2的总量,可采取的措施是( )
A. 加入少量NaOH固体 B. 加入少量CH3COONa固体
C. 加入少量Na2SO4固体 D. 加入少量Na2CO3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com