
【题目】下列叙述正确的是
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.H2S是极性分子,分子中O原子处在2个H原子所连成的直线的中央
C.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
D.CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
【答案】D
【解析】
A.N与3个H原子形成3个![]() 键,孤对电子数为
键,孤对电子数为![]() ,所以N原子采用
,所以N原子采用![]() 杂化,为三角锥形分子,N原子没有处在3个H原子所组成的三角形的中心,A错误;
杂化,为三角锥形分子,N原子没有处在3个H原子所组成的三角形的中心,A错误;
B.H2O中O与2个H形成![]() 键,孤对电子数为
键,孤对电子数为![]() ,所以O原子采用
,所以O原子采用![]() 杂化,为V形分子,分子中O原子不处在2个H原子所连成的直线的中央,该分子正负电荷重心不重合,为极性分子,B错误;
杂化,为V形分子,分子中O原子不处在2个H原子所连成的直线的中央,该分子正负电荷重心不重合,为极性分子,B错误;
C.CCl4中C与4个Cl形成4个![]() 键,孤对电子数为0,所以C原子采用
键,孤对电子数为0,所以C原子采用![]() 杂化,为正四面体结构,该分子正负电荷重心重合,为非极性分子,不是正方形,C错误;
杂化,为正四面体结构,该分子正负电荷重心重合,为非极性分子,不是正方形,C错误;
D.CO2中C与2个O形成![]() 键,孤对电子数为
键,孤对电子数为![]() ,所以C原子采用sp杂化,为直线型分子,分子中C原子和2个O原子在一条直线上,该分子正负电荷重心重合,为非极性分子,D正确;
,所以C原子采用sp杂化,为直线型分子,分子中C原子和2个O原子在一条直线上,该分子正负电荷重心重合,为非极性分子,D正确;
答案选D。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】已知A,B,C,X均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示![]() 部分产物已略去
部分产物已略去![]() 。则A、X不可能是
。则A、X不可能是
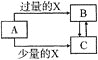
选项 | A | X |
A |
| C |
B |
|
|
C |
| NaOH |
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:

过程I可用如下反应表示:
①2CO2![]() 2CO+O2
2CO+O2
②2H2O![]() 2H2+O2
2H2+O2
③2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
④2CO2+4H2O![]() 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+H2O![]() +3O2
+3O2
请回答下列问题:
(1)过程I的能量转化形式为: 能转化为 能.
(2)请完成第⑤个反应的化学方程式
(3)上述转化过程中,△H1和△H2的关系是
(4)断裂1mol化学键所需的能量见表:
共价键 | H﹣N | H﹣O | N≡N | O=O |
断裂1mol化学键所需能量/kJmol﹣1 | 393 | 460 | 941 | 499 |
常温下,N2和H2O反应生成NH3的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A. 5min时该反应的K值一定小于12 min时的K值
B. 0~5min内,v (H2)=0.05mol/(Lmin)
C. 10 min时,改变的外界条件可能是减小压强
D. 该反应混合气体的平均相对分子质量:5min时小于12 min 时的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在5L 的密闭容器中充入2molX气体和1molY气体发生反应:2X(g)+ Y(g) ![]() 2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
A. 平衡时,X 的转化率为50%
B. 该温度下平衡常数K=10
C. 10min内生成物Z 的反应速率0.2mol·L-1 ·min-1
D. 某一时刻,X、Y、Z的物质的量分别是0.4mol、0.2mol、1.6mol,此刻V正<V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的五种短周期主族元素,A的简单离子核外没有电子,B、C、D位于同一周期,D、E位于同一主族,B元素在自然界中形成的化合物种类最多,D元素的氢化物是最常用的溶剂。
请回答:
(1)BD2的电子式___________________________;
(2)C、D、F离子半径由大到小的顺序为_________________(用离子符号表示)
(3)用一个化学方程式表示证明非金属性F>E:_____________________________
(4)X、Y两种化合物均是强电解质,且均由A、C、D三种元素组成的,X能抑制水的电离,Y能促进水的电离,在一定条件下,X、Y可以相互转化。写出X转化成Y的化学方程式_______________________。
(5)用下面的装置和药品探究A2ED3与AFD的酸性的强弱:

装置连接顺序为_______________(用字母表示),其中装置C的作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将石墨置于熔融的钾或气态钾中,石墨吸收钾形成名称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K 等。下列分析正确的是
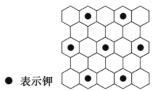
A.题干中所列举的 6 种钾石墨属于有机高分子化合物
B.钾石墨中碳原子的杂化方式是 sp3 杂化
C.若某钾石墨的原子分布如图所示,则它所表示的是 C12K
D.最近两个 K 原子之间距离为石墨中 C—C 键键长的2![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是:
2![]() +KOH→
+KOH→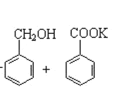 ;
;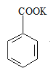 +HCl→
+HCl→![]() +KCl
+KCl
已知:①苯甲醛易被空气氧化;
②苯甲醇沸点为205.3℃;
③苯甲酸熔点为121.7℃,沸点为249℃,溶解度为0.34g;
④乙醚(C2H5OC2H5)沸点为34.8℃,难溶于水,
⑤苯甲酸钾易溶于水,可以与盐酸等强酸发生复分解反应制备苯甲酸。制备苯甲醇和苯甲酸的主要过程如下所示:
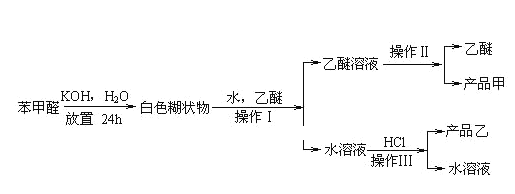
试根据上述信息回答:
(1)苯甲酸在常温下为______态,写出苯甲酸与NaOH反应的方程式:________________。
(2)操作Ⅰ的用到的主要仪器是______,乙醚溶液中所溶解的主要成分是___________。
(3)操作Ⅱ的名称是____________。收集产品甲的适宜温度为___________。
(4)操作Ⅲ的名称是_____________,产品乙是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com