
【题目】实验室制备苯甲醇和苯甲酸的化学原理是:
2![]() +KOH→
+KOH→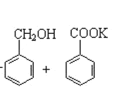 ;
;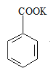 +HCl→
+HCl→![]() +KCl
+KCl
已知:①苯甲醛易被空气氧化;
②苯甲醇沸点为205.3℃;
③苯甲酸熔点为121.7℃,沸点为249℃,溶解度为0.34g;
④乙醚(C2H5OC2H5)沸点为34.8℃,难溶于水,
⑤苯甲酸钾易溶于水,可以与盐酸等强酸发生复分解反应制备苯甲酸。制备苯甲醇和苯甲酸的主要过程如下所示:
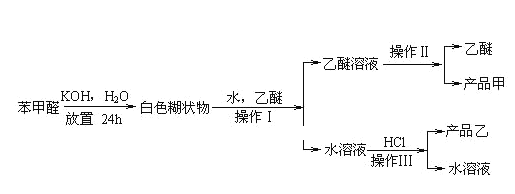
试根据上述信息回答:
(1)苯甲酸在常温下为______态,写出苯甲酸与NaOH反应的方程式:________________。
(2)操作Ⅰ的用到的主要仪器是______,乙醚溶液中所溶解的主要成分是___________。
(3)操作Ⅱ的名称是____________。收集产品甲的适宜温度为___________。
(4)操作Ⅲ的名称是_____________,产品乙是______________。
【答案】固 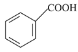 +NaOH→
+NaOH→![]() +H2O 分液漏斗、烧杯 苯甲醇 蒸馏 205.3℃ 过滤 苯甲酸
+H2O 分液漏斗、烧杯 苯甲醇 蒸馏 205.3℃ 过滤 苯甲酸
【解析】
由流程结合题中信息可知,苯甲醛与KOH反应生成白色糊状物为苯甲醇、苯甲酸钾的混合物,然后加水、乙醚萃取苯甲醇,操作Ⅰ为萃取、分液,得到的乙醚溶液中含苯甲醇,操作Ⅱ为蒸馏,得到的产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此分析解答此题。
(1)由题中信息苯甲酸熔点为121.7℃,沸点为249℃可知,苯甲酸在常温下为固态,苯甲酸与NaOH发生中和反应,化学方程式为: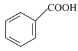 +NaOH→
+NaOH→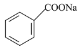 +H2O;
+H2O;
(2)根据以上分析可知操作Ⅰ为萃取、分液,用到的主要仪器有:分液漏斗、烧杯;乙醚溶液中所溶解的主要成分是苯甲醇;
(3)根据以上分析可知操作Ⅱ为蒸馏,得到的产品甲为苯甲醇,由题知苯甲醇沸点为205.3℃,收集产品甲的适宜温度为205.3℃;
(4)根据以上分析可知操作Ⅲ为过滤,由题知苯甲酸在常温下为固态,而且在水中溶解度很小,所以过滤后得到的产品乙为苯甲酸。


科目:高中化学 来源: 题型:
【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ·mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(3)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在大量盆栽鲜花都施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如图,下列关于该分子说法正确的是( )
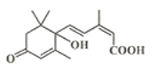
A.该物质的分子式为:C15H18O4
B.1mol该物质可以与2molNa反应,2molNaOH溶液反应
C.1mol该物质可以与4molH2发生加成反应
D.含有碳碳双键、苯环、羟基、羰基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置来测定空气中氧气的含量,硬质玻璃管的体积为20mL,玻璃管两端分别连接带有刻度和注射器的瘪气球,对该实验认识错误的是( )
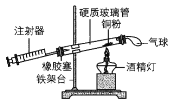
A.气球的作用是调节气压,而且使铜粉充分消耗氧气
B.该实验可以证明空气是混合物
C.在正常操作的情况下,反应结束后消耗氧气的总体积约为注射器中空气体积的五分之一
D.如果停止加热后没有冷却到室温就读数,则测定的氧气体积分数小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M具有广谱抗菌活性,合成M的反应可表示如下:
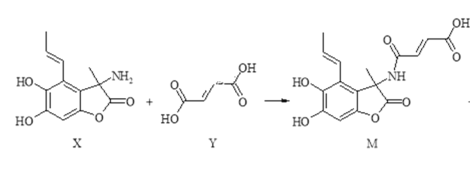 +H2O
+H2O
下列说法正确的是( )
A.X分子中有5种官能团
B.Y分子中所有原子不可能在同一平面内
C.可用FeCl3溶液或NaHCO3溶液鉴别X和M
D.在NaOH溶液中,1molX最多可与4molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
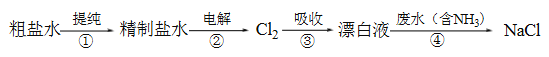
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)纯碱:________,黄铁矿:_____(写化学式)
(2)乙烯和水反应的化学方程式:_____
(3) “腐蚀法”制作印刷电路板的离子方程式:______
(4)铜和浓硫酸反应化学方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示:
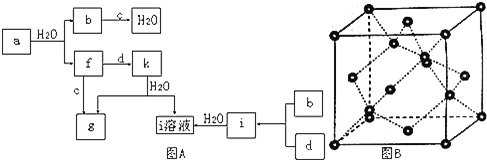
回答下列问题:
(1)图B对应的物质名称是______,晶体类型为______。
(2)d中元素的原子核外电子排布式为 ______
(3)图A中由二种元素组成的物质中,沸点最高的是 ______,原因是______,该物质的分子构型为______。
(4)图A中的双原子分子中,极性最大的分子是______。
(5)k的分子式为______,中心原子的杂化轨道类型为______,属于______分子(填“极性”或“非极性”)。K又称光气,实验室制取时,可用四氯化碳与发烟硫酸(SO3的硫酸溶液)反应。将四氯化碳加热至55-60℃,滴加入发烟硫酸,即发生逸出光气和磺酰氯(该物质在高温时分解成SO2和Cl2),写出制取光气的化学方程式:______。
制取光气也可用氯仿和双氧水直接反应,生成光气和一种极易溶于水的气体,且水溶液呈强酸性,写出该化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
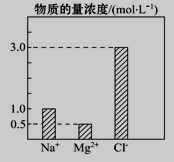
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com