
【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ·mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(3)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)
【答案】-746.5kJ/mol 5:6 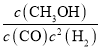 0.12mol·L-1·min-1 33.3%
0.12mol·L-1·min-1 33.3%
【解析】
(1)已知:①N2(g) + O2(g)=2NO(g) △H=+180.5 kJ·mol-1;
②2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1;
③C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1;
根据盖斯定律可知③×2-①-②即得到反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的![]() ;
;
(2)32g甲醇能转移6mol电子即1mol甲醇能够转移6mol电子;1mol硝酸被还原为N2,可转移5mol电子,所以还原剂和氧化剂的物质的量之比为5:6;
(3)①由反应方程式可知,该反应的平衡常数表达式为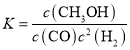 ;
;
②由反应方程式可知,10min内甲醇浓度增加0.6mol/L,那么H2浓度减少了1.2mol/L,这段时间内氢气的反应速率为![]() ;
;
③由反应方程式可知,10min内甲醇的浓度增加了0.6mol/L,那么CO的浓度减少了0.6mol/L,那么CO的转化率为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲同学用图1所示实验装置测定锌与稀硫酸反应的速率
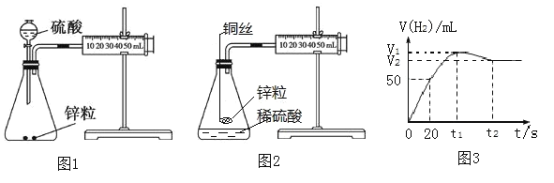
(1)甲同学测得产生H2体积与反应时间的关系如图3所示,该条件下气体摩尔体积为25 L·mol-1 ,溶液体积为40 mL,在20 s内用Zn2+浓度表示的平均反应速率v(Zn2+)=_____________mol·(L·s)-1。
(2)实际测定中发现在t1到t2时段,H2的体积变化如图3所示,试分析变化的原因:________
(3)乙同学认为图1装置中硫酸溶液的体积对H2的体积测定存在一定的影响 ,将实验装置进行如图2所示改进,结果发现产生氢气的速率发生明显变化,分析可能的原因________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
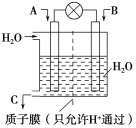
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为___极,该极的电极反应式为___。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为___。
③若A为NH3,B为O2,C为HNO3,则正极的电极反应式为___。
④若用上述①作电池电解200mL含有0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(电极均为惰性电极),当消耗标况下0.448LH2时,阳极产生的气体为___(填化学式),其物质的量为___,溶液的pH=___(忽略铜离子水解,假设电解前后溶液体积不变)。
(2)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置(均为惰性电极)
Cr2O72-+H2O设计图示装置(均为惰性电极)
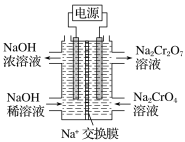
电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的___极,其电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________。
(2)A和D与氢元素形成的最简单氢化物中,其中沸点较高的是_____(填分子式),原因是________________;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为______,中心原子的杂化轨道类型为______。
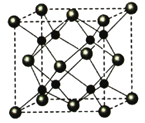
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞边长a=5.66x10-8cm, F 的化学式为______:晶胞中A 原子的配位数为_________;列式计算晶体F的密度(g·cm-3)_______________________________。(列算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两份过量的锌粉 a、b 分别加入定量的稀硫酸,同时向 a 中加入少量的 CuSO4 溶液,产生H2 的体积 V(L)与时间 t(min)的关系正确的是( )。
A.
B.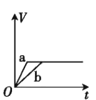
C.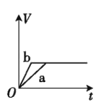
D.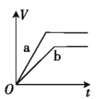
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) +Cu(s) =Cu2+(aq) +2Ag(s)设计的原电池如图所示。请回答下列问题:
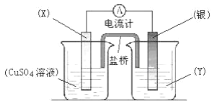
(1)电极 X 的材料是_____; 电解质溶液 Y 是________;
(2)银电极为电池的_____极,发生的电极反应为____________X 电极上发生的电极反应为__________
(3)外电路中的电子是从_____电极流向_____电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是:
2![]() +KOH→
+KOH→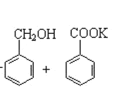 ;
;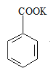 +HCl→
+HCl→![]() +KCl
+KCl
已知:①苯甲醛易被空气氧化;
②苯甲醇沸点为205.3℃;
③苯甲酸熔点为121.7℃,沸点为249℃,溶解度为0.34g;
④乙醚(C2H5OC2H5)沸点为34.8℃,难溶于水,
⑤苯甲酸钾易溶于水,可以与盐酸等强酸发生复分解反应制备苯甲酸。制备苯甲醇和苯甲酸的主要过程如下所示:
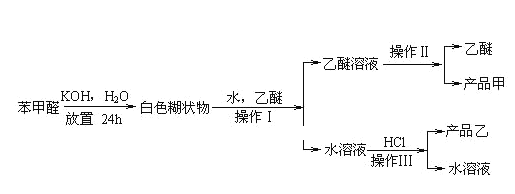
试根据上述信息回答:
(1)苯甲酸在常温下为______态,写出苯甲酸与NaOH反应的方程式:________________。
(2)操作Ⅰ的用到的主要仪器是______,乙醚溶液中所溶解的主要成分是___________。
(3)操作Ⅱ的名称是____________。收集产品甲的适宜温度为___________。
(4)操作Ⅲ的名称是_____________,产品乙是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com