
����Ŀ��A��B��C��DΪԭ�������������������Ԫ�أ�A2-��B+������ͬ�ĵ��ӹ��ͣ�C�� DΪͬ����Ԫ�أ�C�������������������������3����DԪ���������һ��δ�ɶԵ��ӡ��ش��������⣺
(1)����Ԫ���е縺��������______(��Ԫ�ط���)������Cԭ�ӵĺ�������Ų�ʽΪ__________��
(2)A��D����Ԫ���γɵ�����⻯���У����зе�ϸߵ���_____(�����ʽ)��ԭ����________________��A��B���⻯�������ľ������ͷֱ�Ϊ______��______��
(3)C��D��Ӧ��������ɱ�Ϊ1��3�Ļ�����E�� E�����幹��Ϊ______������ԭ�ӵ��ӻ��������Ϊ______��
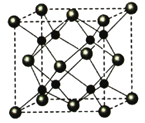
(4)A��B�ܹ��γɻ�����F���侧���ṹ��ͼ��ʾ�������߳�a��5.66x10-8cm�� F �Ļ�ѧʽΪ______��������A ԭ�ӵ���λ��Ϊ_________����ʽ���㾧��F���ܶ�(g��cm-3)_______________________________��(����ʽ����)
���𰸡�O 1s22s22p63s23p3 H2O ˮ����֮�����γ���� ���Ӿ��� ���Ӿ��� ������ sp3 Na2O 8 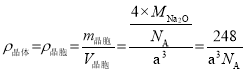
��������
��A2-��B+������ͬ�ĵ��Ӳ�ṹ��֪��A��Bλ���������ڣ�����AΪ��AԪ�� ��BΪ��AԪ�أ���C�ĺ����������Ϊ������������3����֪�������������Ӹ���Ϊ5ʱ����������CΪPԪ�أ���ôA��B�ֱ�ΪO��NaԪ�أ�����D��Cͬ���ڣ���DԪ�������ֻ��һ��δ�ɶԵ��ӣ���ôDΪClԪ�ء�
(1)���ڱ������ң�Ԫ�صĵ縺��������ڱ����ϵ��£�Ԫ�صĵ縺����С���������Ԫ���е縺��������O��ͨ��������֪��CΪPԪ�أ����̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p3��
(2)ͨ��������֪��AΪOԪ�أ�DΪClԪ�أ�BΪNaԪ�أ�O��Cl�γɵļ��⻯��ֱ�ΪH2O��HCl������H2O�ķе�ϸߣ���ΪH2O���Ӽ�����γ������A�γɵ��⻯��ΪH2O�����ڷ��Ӿ��壻B�γɵ��⻯��ΪNaH���������Ӿ��壻
(3)ͨ��������֪��EΪPCl3������3���ɼ����Ӷ��Լ�һ���µ��Ӷԣ����ӹ���Ϊ�����Σ�Pԭ�Ӳ���sp3�ӻ���ʽ�γɵ��ӻ������
(4)ͨ��������֪��AΪOԪ�أ�BΪNaԪ�أ��ɾ����ṹ��֪�������ھ����������Լ����㴦��С���ھ������ڲ������һ�������д����С��ĸ�����Ϊ1:2������O2-�뾶����Na+�����Ը����ʼ�ΪNa2O��A��Ӧ�����Ӽ�O2-���Ǿ����нϴ������λ��Ϊ8���þ�����ܶ�Ϊ��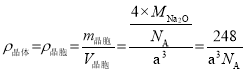 ��
��


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
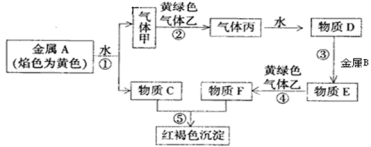
����Ŀ�����н�������A��B������ס��ҡ����Լ�����C��D��E��F������֮���ܷ�����ͼ��Ӧ����ͼ����Щ��Ӧ�IJ���ͷ�Ӧ����û�б����
��ش��������⣺
��1�����Ļ�ѧʽΪ____��
��2��A��һ��������Ϊ����ɫ���壬�����ʵĵ���ʽΪ___��
��3��д����������C��Һ��Ӧ�����ӷ���ʽ��____��
��4������C��Һ��E��Һ��ϣ�����Թ۲쵽�������ǣ�____��
��5������F��Һʱ��Ҫ��F���������ڽ�Ũ�������У��ټ�ˮϡ�ͣ���Ŀ����___(�ü����ֺ����ӷ���ʽ˵��)��
��6�����һ�ּ�������E��Һ�н���������ʵ�鷽����____(д��ʵ�鲽�裬����ͽ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������Һ�е����й�ϵʽ����ȷ���ǣ� ��
A.0.1molL��1 CH3COOH��Һ��ˮϡ�ͣ�n(H+)����
B.��0.1molL-1�İ�ˮ�еμ�0.1molL��1���ᣬǡ����ȫ�к�ʱ��Һ��pH=a������ˮ���������c��OH����=10��amolL��1
C.��cmolL-1�Ĵ�����Һ��0.02molL-1NaOH��Һ�������Ϻ���Һǡ�ó����ԣ��ú�c�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��Ka=![]()
D.��֪A��+H2B���������THA+HB��������H+��������A����HB����B2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���ǣ� ��
A. H2SO4+2NaOH==Na2SO4+2H2O
B. 2NaHCO3![]() Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O
C. NH3+HCl==NH4Cl
D. CuO+H2![]() Cu+H2O
Cu+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����ֵ������˵����ȷ���ǣ� ��
A.46gNO2��N2O4��������к���ԭ����Ϊ3.5NA
B.50g��������Ϊ46%���Ҵ�ˮ��Һ����ԭ����Ϊ2NA
C.�ö��Ե缫���H2SO4��Һ������������5.6L���壬���·��ͨ��0.5NA����
D.�����£�1LpH=3�Ĵ�����Һϡ�͵�10Lʱ����Һ��H+����Ŀ����0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
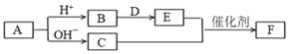
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�ij��������Ҿ�����ͬһ��Ԫ�أ�����֮���ת����ϵ��ͼ��ʾ(��Ӧ���������������Ѿ���ȥ)��
![]()
(1)��A��һ�ֽ�����C�ǵ���ɫ���壬д��C��һ����;____��
(2)��������AΪ����ɫ���嵥�ʣ�DΪǿ�ᣬ��BΪ___��D��Ũ��Һ��ʹ��������������ף�������D��___�ԡ�
(3)��A�ǻ����C�Ǻ���ɫ���壬��
��A�ĵ���ʽΪ___��ʵ�����Ʊ�A����Ļ�ѧ����ʽΪ___��
��ʵ���Ҽ���A����ķ���Ϊ___��
��Cת��ΪD�Ĺ����У��������뻹ԭ����������Ϊ___��
�ܽ�ʢ��B������Թܵ�����ˮ���У���ͨ��һ����O2����������ȫ�������գ�������Һ���������Թܡ�����������Һ��ɢ������������Һ���ʵ���Ũ��Ϊ___mol��L-1��(����¼��㣬������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ������������������Դ���õ��ǵ����������Ż��⡣�������ѧ��ѧ֪ʶ�ش��������⣺
(1)�����ϰ�װ��ת��������ʹ����β���е���Ҫ��Ⱦ��(CO��NOx��̼�⻯����)�������Ӧ�����������ʣ���������β����Ⱦ��
��֪��N2(g) + O2(g)��2NO(g) ��H��+180.5 kJ��mol��1��
2C(s)+ O2(g)��2CO(g) ��H����221.0 kJ��mol��1��
C(s)+ O2(g)��CO2(g) ��H����393.5 kJ��mol��1��
��β��ת����Ӧ2NO(g) +2CO(g)��N2(g)+2CO2(g)�ġ�H��________________��
(2)ij���᳧���ü״�������ˮ����һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32 g CH3OHת��6 mol���ӣ���μӷ�Ӧ�Ļ�ԭ���������������ʵ���֮��Ϊ______________��
(3)ú�ļ��Һ������ת��ΪCO��H2�����ڴ��������ºϳɼ״�������һ���¶��£���1 L�ܱ������м���CO��H2��������ӦCO(g)+2H2(g)CH3OH(g)����10 min��Ӧ�ﵽƽ��ʱ��ø���ֵ�Ũ�����£�
���� | CO | H2 | CH3OH |
Ũ��/(mol��L��1) | 1.2 | 1.0 | 0.6 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ��K��_____________________��
�ڸ�ʱ���ڷ�Ӧ������(H2)��_________________��
��ƽ��ʱCO��ת����Ϊ_________________(����1λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��.����������Ԫ��a��b��c��d��e��ԭ��������������A��B��C��D��E��F����������Ԫ����ɵ���ѧ��ѧ�������ʣ�����A����Ԫ�ػ����C����ʹʪ���ɫʯ����ֽ���������壬D�ǵ���ɫ���廯���E�ǵ��ʡ�������֮���������ͼת����ϵ(���ֲ���δ���)������˵������ȷ���ǣ� ��
A.�����Ӱ뾶��С��ϵ��c��d��e
B.�������ӵĻ�ԭ�ԣ�c��a��d
C.�⻯��ķе㣺c<d
D.�����22.4LC��Eǡ�÷�Ӧʱת�Ƶĵ�����Ϊ5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�����ⶨ�����������ĺ�����Ӳ�ʲ����ܵ����Ϊ20mL�����������˷ֱ����Ӵ��п̶Ⱥ�ע�����ı����Ը�ʵ����ʶ������ǣ� ��
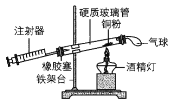
A.����������ǵ�����ѹ������ʹͭ�۳����������
B.��ʵ�����֤�������ǻ����
C.����������������£���Ӧ���������������������ԼΪע�����п�����������֮һ
D.���ֹͣ���Ⱥ�û����ȴ�����¾Ͷ�������ⶨ�������������С��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com