
【题目】甲同学用图1所示实验装置测定锌与稀硫酸反应的速率
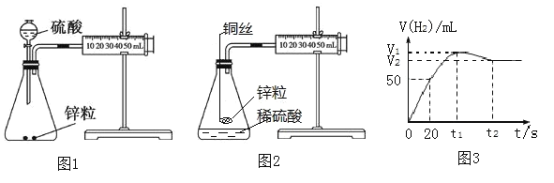
(1)甲同学测得产生H2体积与反应时间的关系如图3所示,该条件下气体摩尔体积为25 L·mol-1 ,溶液体积为40 mL,在20 s内用Zn2+浓度表示的平均反应速率v(Zn2+)=_____________mol·(L·s)-1。
(2)实际测定中发现在t1到t2时段,H2的体积变化如图3所示,试分析变化的原因:________
(3)乙同学认为图1装置中硫酸溶液的体积对H2的体积测定存在一定的影响 ,将实验装置进行如图2所示改进,结果发现产生氢气的速率发生明显变化,分析可能的原因________
【答案】0.0025 温度降低,气体体积减小 形成Cu-Zn原电池,加快了反应速率
【解析】
(1)根据v=![]() 来计算化学反应速率;
来计算化学反应速率;
(2)观察到锌与稀硫酸反应初期,反应放热,温度升高,反应速率加快;反应进行一定时间后,酸中氢离子浓度减小,反应速率减慢,在金属锌和硫酸的反应中,接近反应的最后阶段,由于气体的热胀冷缩性质,会发现气体的体积突然减小;
(3)改进后,硫酸、铜和锌形成原电池。
(1)根据金属锌和硫酸反应的实质是:Zn+2H+=Zn2++H2↑,产生氢气50mL时,n(H2)物质的量是![]() =0.020mol,等于锌离子的物质的量,在20 s内用Zn2+浓度表示的平均反应速率v(Zn2+)==
=0.020mol,等于锌离子的物质的量,在20 s内用Zn2+浓度表示的平均反应速率v(Zn2+)== = 0.0025mol·(L·s)-1。故答案为:0.0025;
= 0.0025mol·(L·s)-1。故答案为:0.0025;
(2)在金属锌和硫酸的反应中,接近反应的最后阶段,由于气体的热胀冷缩性质,会发现气体的体积突然减小,所以气体体积变化的原因:温度降低,气体体积减小,故答案为:温度降低,气体体积减小;
(3)改进后,硫酸、铜和锌形成原电池,产生氢气的速率发生明显变化,所以可能的原因形成Cu-Zn原电池,加快了反应速率,故答案为:形成Cu-Zn原电池,加快了反应速率。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列叙述不正确的是( )
![]()
A.化合物(ZXY)2中Z元素的化合价为-2价
B.Y的氧化物对应的水化物可能是弱酸
C.(ZXY)2分子中X原子的杂化方式为sp杂化
D.X、Y、Z、W四种元素电负性的大小顺序为:Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置图的叙述中,正确的是

① ②
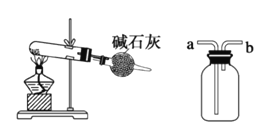
③ ④
A. 装置①:常用于分离互不相溶的液体混合物
B. 装置②:可用于吸收氯化氢、氨气等气体尾气,防止倒吸
C. 装置③:可用于实验室以氯化铵为原料制备少量NH3的实验
D. 装置④:先装满水,再从b口进NO气体,可收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
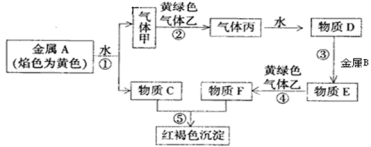
请回答下列问题:
(1)丙的化学式为____。
(2)A的一种氧化物为淡黄色固体,该物质的电子式为___。
(3)写出气体乙与C溶液反应的离子方程式:____。
(4)若将C溶液与E溶液混合,则可以观察到的现象是:____。
(5)配制F溶液时,要将F固体先溶于较浓的盐酸中,再加水稀释,其目的是___(用简单文字和离子方程式说明)。
(6)设计一种检验物质E溶液中金属阳离子实验方案:____(写出实验步骤,现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH = -38.6 kJ/mol
2NH3(g) ΔH = -38.6 kJ/mol
C.已知热化学方程式:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH = -Q kJ/mol ,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化
2SO3(g) ΔH = -Q kJ/mol ,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化
D.X(g)+Y(g)![]() Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.铝粉投入到NaOH溶液中:Al+2OH-=![]() +H2↑
+H2↑
C.氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+
D.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
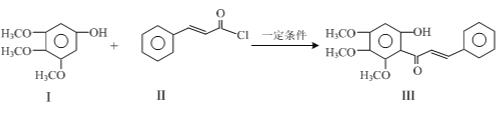 +HCl
+HCl
下列有关叙述正确的是
A.I的分子式为C9H10O4
B.II中所有原子有可能均共面
C.可用FeCl3溶液鉴别有机物I和III
D.1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液中的下列关系式不正确的是( )
A.0.1molL-1 CH3COOH溶液加水稀释,n(H+)增大
B.在0.1molL-1的氨水中滴加0.1molL-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-amolL﹣1
C.将cmolL-1的醋酸溶液与0.02molL-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=![]()
D.已知A-+H2B(过量)═HA+HB-,则结合H+的能力:A-<HB-<B2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ·mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(3)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com