
����Ŀ����1�����õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�ϣ�װ����ͼ��ʾ��
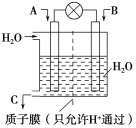
����AΪCO��BΪH2��CΪCH3OH����ͨ��CO��һ��Ϊ___�����ü��ĵ缫��ӦʽΪ___��
����AΪSO2��BΪO2��CΪH2SO4�����ĵ缫��ӦʽΪ___��
����AΪNH3��BΪO2��CΪHNO3���������ĵ缫��ӦʽΪ___��
����������������ص��200mL����0.1mol��L��1NaCl��0.1mol��L��1CuSO4�Ļ����Һ(�缫��Ϊ���Ե缫)�������ı����0.448LH2ʱ����������������Ϊ___(�ѧʽ)�������ʵ���Ϊ___����Һ��pH��___(����ͭ����ˮ�⣬������ǰ����Һ�������)��
��2������2CrO42-��2H��![]() Cr2O72-��H2O���ͼʾװ��(��Ϊ���Ե缫)
Cr2O72-��H2O���ͼʾװ��(��Ϊ���Ե缫)
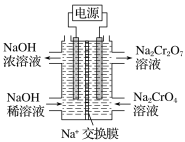
���Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ��___������缫��ӦʽΪ___��
���𰸡��� CO+4e-+4H+=CH3OH SO2+2H2O-2e-= SO42-+4H+ O2+4e-+4H+=2H2O Cl2��O2 0.01mol��0.005mol 1 �� 4 OH--4e- = O2��+2H2O
��������
�����������õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�Ͽ�֪�����⿼��绯ѧ֪ʶ������ԭ���ԭ���͵���ԭ��������
��1����ȼ�ϵ���У�ͨ���������ĵ缫��������ͨ�뻹ԭ���ĵ缫�Ǹ������÷�Ӧ��CԪ�ػ��ϼ���+2�۱�Ϊ-2�ۡ�HԪ�ػ��ϼ���0�۱�Ϊ+1�ۣ�����CO������������ͨ��CO�ĵ缫Ϊ�������缫����ʽΪCO+4e-+4H+=CH3OH��
�ʴ�Ϊ������CO+4e-+4H+=CH3OH��
����AΪSO2��BΪO2��CΪH2SO4�������϶�������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ��缫��ӦʽΪSO2+2H2O-2e-= SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-= SO42-+4H+��
����AΪNH3��BΪO2��CΪHNO3��������������ԭ��Ӧ�������õ�������ˮ���缫����ʽΪO2+4e-+4H+=2H2O��
�ʴ�Ϊ��O2+4e-+4H+=2H2O��
�ܼ���õ�����⺬��0.02mol CuSO4��0.02molNaCl�Ļ����Һ200mL�������ı����0.448LH2ʱ��![]() �����·��ת����0.04mole-�����ݵ缫��Ӧ�͵����غ�����жϣ�������2Cl- - 2e- = Cl2�� ��
�����·��ת����0.04mole-�����ݵ缫��Ӧ�͵����غ�����жϣ�������2Cl- - 2e- = Cl2�� ��
0.02mol 0.02mol 0.01mol
4OH- - 4e- = 2H2O + O2��
0.02mol 0.02mol 0.005mol
������Cu2+ + 2e- = Cu
0.02mol 0.04mol
�������������Ӽ���0.02mol������Һ������������0.02mol����Һ��������Ũ��=![]() ����ҺpH=1��
����ҺpH=1��
�ʴ�Ϊ��Cl2��O2�� 0.01mol��0.005mol��1��
��2������2CrO42-+2H+ ![]() Cr2O72-+H2O���ͼʾװ�ã���Ϊ���Ե缫�����NaCrO4��Һ��ȡNaCr2O7����Ҫͨ���������OH-�������Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ���������缫��ӦʽΪ4OH--4e-=O2��+2H2O��
Cr2O72-+H2O���ͼʾװ�ã���Ϊ���Ե缫�����NaCrO4��Һ��ȡNaCr2O7����Ҫͨ���������OH-�������Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ���������缫��ӦʽΪ4OH--4e-=O2��+2H2O��
�ʴ�Ϊ������4OH--4e- = O2��+2H2O��


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ��ͼ�������У���ȷ����

�� ��
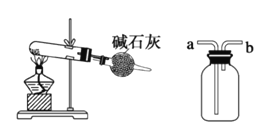
�� ��
A. װ�â٣������ڷ��뻥�����ܵ�Һ������
B. װ�âڣ������������Ȼ��⡢����������β������ֹ����
C. װ�âۣ�������ʵ�������Ȼ��Ϊԭ���Ʊ�����NH3��ʵ��
D. װ�âܣ���װ��ˮ���ٴ�b�ڽ�NO���壬���ռ�NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǻϳ���ҩ�����е���Ҫ���Գɷֵ��м��壬�ϳɷ������£�
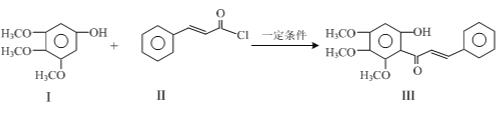 +HCl
+HCl
�����й�������ȷ����
A��I�ķ���ʽΪC9H10O4
B��II������ԭ���п��ܾ�����
C������FeCl3��Һ�����л���I��III
D��1 mol����III��������ˮ��Ӧ������Br2�����ʵ���Ϊ1.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������Һ�е����й�ϵʽ����ȷ���ǣ� ��
A.0.1molL��1 CH3COOH��Һ��ˮϡ�ͣ�n(H+)����
B.��0.1molL-1�İ�ˮ�еμ�0.1molL��1���ᣬǡ����ȫ�к�ʱ��Һ��pH=a������ˮ���������c��OH����=10��amolL��1
C.��cmolL-1�Ĵ�����Һ��0.02molL-1NaOH��Һ�������Ϻ���Һǡ�ó����ԣ��ú�c�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��Ka=![]()
D.��֪A��+H2B���������THA+HB��������H+��������A����HB����B2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ѵ����������ɷֿɱ�ʾΪFeTiO3(TiΪ+4��)���Ѱ�(TiO2)Ϳ�ϡ����ϡ���ī����ֽ��ҵ���й㷺����;���Ʊ�������ͼ��
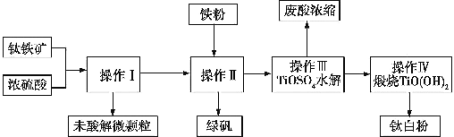
(1)�����������ᷴӦʱ�ɱ�ʾΪFeTiO3+H2SO4��TiOSO4+X+H2O������X�Ļ�ѧʽΪ ______���÷�ӦΪ______ (����������ԭ��Ӧ��������������ԭ��Ӧ��)��
(2)ij��������FeTiO3�ĺ���Ϊ76%���������������ᷴӦʱTiת����Ϊ92%������I������IV�Ĺ�����Ti��ת����Ϊ96%����1t��������������Ѱ� ______ t(���м�����������λ��Ч����)���ܷ�����̷��IJ���______��(�����������ֵ������˵������)��
(3)����I�������� ______������II�������衢�ᾧ��______������II�м������۵�Ŀ����______(�����ӷ���ʽ��ʾ)��
(4)д������III��TiOSO4ˮ��Ļ�ѧ����ʽ�� ______ ��
(5)�����������в�����β��SO2��SO3�Ĵ��������� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���ǣ� ��
A. H2SO4+2NaOH==Na2SO4+2H2O
B. 2NaHCO3![]() Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O
C. NH3+HCl==NH4Cl
D. CuO+H2![]() Cu+H2O
Cu+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����ֵ������˵����ȷ���ǣ� ��
A.46gNO2��N2O4��������к���ԭ����Ϊ3.5NA
B.50g��������Ϊ46%���Ҵ�ˮ��Һ����ԭ����Ϊ2NA
C.�ö��Ե缫���H2SO4��Һ������������5.6L���壬���·��ͨ��0.5NA����
D.�����£�1LpH=3�Ĵ�����Һϡ�͵�10Lʱ����Һ��H+����Ŀ����0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ������������������Դ���õ��ǵ����������Ż��⡣�������ѧ��ѧ֪ʶ�ش��������⣺
(1)�����ϰ�װ��ת��������ʹ����β���е���Ҫ��Ⱦ��(CO��NOx��̼�⻯����)�������Ӧ�����������ʣ���������β����Ⱦ��
��֪��N2(g) + O2(g)��2NO(g) ��H��+180.5 kJ��mol��1��
2C(s)+ O2(g)��2CO(g) ��H����221.0 kJ��mol��1��
C(s)+ O2(g)��CO2(g) ��H����393.5 kJ��mol��1��
��β��ת����Ӧ2NO(g) +2CO(g)��N2(g)+2CO2(g)�ġ�H��________________��
(2)ij���᳧���ü״�������ˮ����һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32 g CH3OHת��6 mol���ӣ���μӷ�Ӧ�Ļ�ԭ���������������ʵ���֮��Ϊ______________��
(3)ú�ļ��Һ������ת��ΪCO��H2�����ڴ��������ºϳɼ״�������һ���¶��£���1 L�ܱ������м���CO��H2��������ӦCO(g)+2H2(g)CH3OH(g)����10 min��Ӧ�ﵽƽ��ʱ��ø���ֵ�Ũ�����£�
���� | CO | H2 | CH3OH |
Ũ��/(mol��L��1) | 1.2 | 1.0 | 0.6 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ��K��_____________________��
�ڸ�ʱ���ڷ�Ӧ������(H2)��_________________��
��ƽ��ʱCO��ת����Ϊ_________________(����1λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڴ��������ʻ���ʩ����S�տ����Ƽ����Ա����ʻ�ʢ����S�տ��صķ��ӽṹ��ͼ�����й��ڸ÷���˵����ȷ����( )
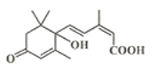
A.�����ʵķ���ʽΪ��C15H18O4
B.1mol�����ʿ�����2molNa��Ӧ��2molNaOH��Һ��Ӧ
C.1mol�����ʿ�����4molH2�����ӳɷ�Ӧ
D.����̼̼˫�����������ǻ����ʻ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com