
【题目】钛铁矿是铁和钛的氧化物矿物,成分可表示为FeTiO3(Ti为+4价)。钛白粉(TiO2)涂料、塑料、油墨、造纸行业具有广泛的用途,制备流程如图:
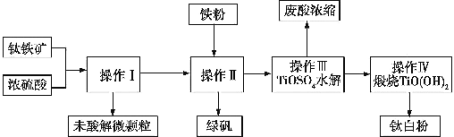
(1)钛铁矿与硫酸反应时可表示为FeTiO3+H2SO4→TiOSO4+X+H2O,其中X的化学式为 ______,该反应为______ (填“氧化还原反应”或“非氧化还原反应”)。
(2)某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿可生产钛白粉 ______ t(所有计算结果保留两位有效数字),能否计算绿矾的产量______?(若能则计算数值,否则说明理由)。
(3)操作I的名称是 ______,操作II包括搅拌、结晶、______,操作II中加入铁粉的目的是______(用离子方程式表示)。
(4)写出操作III中TiOSO4水解的化学方程式: ______ 。
(5)该生产过程中产生的尾气SO2、SO3的处理方法是 ______ 。
【答案】FeSO4 非氧化还原反应 0.35 在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量 过滤 过滤 Fe+2Fe3+=3Fe2+ TiOSO4+2H2O=TiO(OH)2↓+H2SO4 用碱液吸收
【解析】
(1)根据原子守恒可确定X的化学式,根据反应前后元素的化合价是否发生改变判断反应是否为氧化还原反应;
(2)根据元素守恒得:FeTiO3~TiO2,利用FeTiO3在反应过程中的利用率来计算二氧化钛的质量;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也未知,因此不能计算绿矾的产量;
(3)从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;从溶液中得到晶体的操作为结晶后过滤;铁粉与可能生成的+3价的铁离子反应生成+2价的亚铁离子;
(4)根据水解原理:TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-来书写方程式;
(5)因SO2、SO3是酸性氧化物,可以和碱液之间反应,据此解答。
钛铁矿与硫酸反应:FeTiO3+H2SO4=TiOSO4+FeSO4+H2O,然后过滤出未被酸溶解的物质,向所得到的滤液中加入铁粉可以得到了绿矾,将滤液控制在一定的条件,使TiOSO4发生水解:TiOSO4+2H2O=TiO(OH)2↓+H2SO4,将过滤出的沉淀进行煅烧,可以得到钛白粉TiO2。
(1)根据原子守恒可知X的化学式为FeSO4,在FeTiO3中Ti为+4价,O为-2价,Fe为+2价,反应前后所有元素的化合价都没有发生改变,因此反应为非氧化还原反应;
(2)假设得到TiO2的质量是m,则根据元素守恒得关系式:FeTiO3~TiO2。则二者转化的质量关系为152~~80,某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿中含有FeTiO3的质量为1t×76%×92%×96%,假设反应产生的TiO2质量为m,则![]() =
=![]() ,解得m=0.35t;由于在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也未知,因此不能计算反应产生的绿矾的产量;
,解得m=0.35t;由于在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也未知,因此不能计算反应产生的绿矾的产量;
(3)在操作I从溶液中得到了没有与酸反应的颗粒状物质,则所需继续的操作为过滤;在操作II加入铁粉后得到了绿矾,应是从溶液中得到晶体的操作为结晶后再过滤;在操作II加入铁粉的目的是为了防止在制备过程中钛铁矿+2价的铁生成+3价的铁使制备的绿矾中含有杂质,故应加入铁粉与生成的+3价的铁反应生成+2价的铁,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
(4)TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-,故反应方程式为:TiOSO4+2H2O=TiO(OH)2↓+H2SO4;
(5)因SO2、SO3都是酸性氧化物,能够与碱反应产生可溶性盐,所以应用碱液进行吸收。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,有机化合物 Y 可发生重排反应:
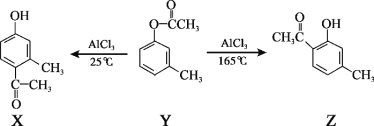
下列说法不正确的是( )
A.X、Y、Z互为同分异构体
B.1 mol X最多能与3 mol H2发生加成反应
C.可以用FeCl3溶液区分Y和Z
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机合成中官能团的引入或改变是极为重要的,下列说法正确的是( )
A.甲苯在光照下与Cl2反应,主反应为苯环上引入氯原子
B.引入羟基的方法常有卤代烃和酯的水解、烯烃的加成、醛类的还原
C.将CH2=CH—CH2OH与酸性KMnO4溶液反应即可得到CH2=CH—COOH
D.HC≡CH、(CN)2、CH3COOH三种单体在一定条件下发生加成、酯化反应即可得到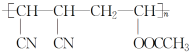
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸的质量分数为![]() ,密度为
,密度为![]() 。
。
(1)此盐酸的物质的量浓度为____________。
(2)需要![]() 的盐酸,配制时需以上浓盐酸的体积为_____
的盐酸,配制时需以上浓盐酸的体积为_____![]() 。
。
(3)上述实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒以及____________(两种仪器)。
(4)用浓盐酸配制![]() 稀盐酸,操作步骤的正确顺序是__________(填字母代号)。
稀盐酸,操作步骤的正确顺序是__________(填字母代号)。
a.计算需要浓盐酸的体积
b.用量筒量取浓盐酸
c.将烧杯中的溶液注入所需容积的容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶
d.把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却
e.盖好瓶塞,反复上下颠倒,摇匀
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm处,改用某仪器小心滴加蒸馏水至凹液面与刻度线相平
(5)下列操作使溶液物质的量浓度偏高的是:____________。
A.量取浓盐酸时仰视刻度线
B.容量瓶洗净后未经干燥处理
C.未冷却至室温就转移定容
D.没有将洗涤液转移到容量瓶中
E.定容时俯视刻度线
F.摇匀后立即观察,发现溶液未达到刻度线,再加几滴蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某恒容密闭容器中,建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)。在一定条件下不能表示该可逆反应已达到化学平衡状态的是( )
A.体系压强不再发生变化
B.v正(CO)=v逆(H2O)
C.体系的气体的密度不再变化
D.1 mol HH 键断裂的同时形成 2 mol HO 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
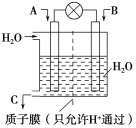
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为___极,该极的电极反应式为___。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为___。
③若A为NH3,B为O2,C为HNO3,则正极的电极反应式为___。
④若用上述①作电池电解200mL含有0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(电极均为惰性电极),当消耗标况下0.448LH2时,阳极产生的气体为___(填化学式),其物质的量为___,溶液的pH=___(忽略铜离子水解,假设电解前后溶液体积不变)。
(2)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置(均为惰性电极)
Cr2O72-+H2O设计图示装置(均为惰性电极)
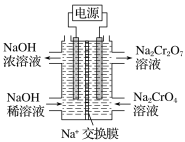
电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的___极,其电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两份过量的锌粉 a、b 分别加入定量的稀硫酸,同时向 a 中加入少量的 CuSO4 溶液,产生H2 的体积 V(L)与时间 t(min)的关系正确的是( )。
A.
B.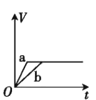
C.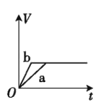
D.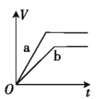
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用原电池原理设计实验,验证 Cu2+、Fe3+氧化性的强弱。请写出电极反应式。
(1)负极 __________________________
(2)正极 __________________________________
(3)并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路中电子流向。________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com