
【题目】化合物M具有广谱抗菌活性,合成M的反应可表示如下:
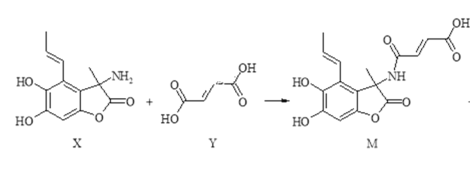 +H2O
+H2O
下列说法正确的是( )
A.X分子中有5种官能团
B.Y分子中所有原子不可能在同一平面内
C.可用FeCl3溶液或NaHCO3溶液鉴别X和M
D.在NaOH溶液中,1molX最多可与4molNaOH发生反应
科目:高中化学 来源: 题型:
【题目】将两份过量的锌粉 a、b 分别加入定量的稀硫酸,同时向 a 中加入少量的 CuSO4 溶液,产生H2 的体积 V(L)与时间 t(min)的关系正确的是( )。
A.
B.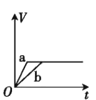
C.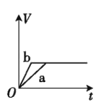
D.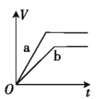
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用原电池原理设计实验,验证 Cu2+、Fe3+氧化性的强弱。请写出电极反应式。
(1)负极 __________________________
(2)正极 __________________________________
(3)并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路中电子流向。________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:

下列说法正确的是
A. 实验开始时,先点燃酒精灯,后打开活塞K
B. b、c、f中试剂依次为氢氧化钠溶液、浓硫酸、银氨溶液
C. 装置e的作用是收集一氧化碳气体
D. 用上述装置(另择试剂)可以制备氢气并探究其还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是:
2![]() +KOH→
+KOH→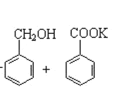 ;
;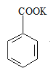 +HCl→
+HCl→![]() +KCl
+KCl
已知:①苯甲醛易被空气氧化;
②苯甲醇沸点为205.3℃;
③苯甲酸熔点为121.7℃,沸点为249℃,溶解度为0.34g;
④乙醚(C2H5OC2H5)沸点为34.8℃,难溶于水,
⑤苯甲酸钾易溶于水,可以与盐酸等强酸发生复分解反应制备苯甲酸。制备苯甲醇和苯甲酸的主要过程如下所示:
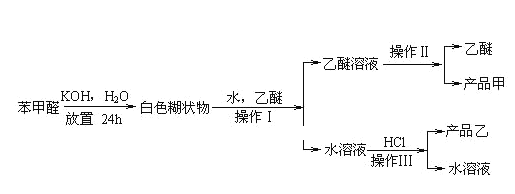
试根据上述信息回答:
(1)苯甲酸在常温下为______态,写出苯甲酸与NaOH反应的方程式:________________。
(2)操作Ⅰ的用到的主要仪器是______,乙醚溶液中所溶解的主要成分是___________。
(3)操作Ⅱ的名称是____________。收集产品甲的适宜温度为___________。
(4)操作Ⅲ的名称是_____________,产品乙是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 NaOH 和Na2CO3 混合溶液中滴加 0.1 mol·L1 稀盐酸,CO2 的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
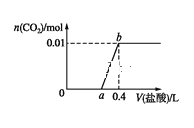
A.在 0~a 范围内,发生中和反应和 CO32-+H+=HCO3-
B.ab 段发生反应的离子方程式为: CO32-+2H+ CO2 +H2O
C.a=0.2
D.原混合溶液中NaOH 与 Na2CO3 的物质的量之比为 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。

请回答:
(1) 仪器1的名称________。装置5的作用________。
(2) 实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中________。
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
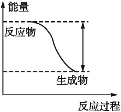
(1)该反应为_________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是_________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.使用催化剂
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为:_________(填“正”或“负”)极,该极上发生的电极反应为:_________,外电路中电子移动方向为:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com