
【题目】按要求填空
(1)纯碱:________,黄铁矿:_____(写化学式)
(2)乙烯和水反应的化学方程式:_____
(3) “腐蚀法”制作印刷电路板的离子方程式:______
(4)铜和浓硫酸反应化学方程式:_______
【答案】Na2CO3 FeS2 CH2=CH2+H2O![]() CH3CH2OH 2Fe3++Cu=2Fe2++Cu2+ Cu+2H2SO4(浓)
CH3CH2OH 2Fe3++Cu=2Fe2++Cu2+ Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】
(1)纯碱是碳酸钠的俗名,化学式为Na2CO3,黄铁矿的主要成分是二硫化亚铁,化学式为FeS2。答案为:Na2CO3;FeS2;
(2)乙烯和水在催化剂作用下发生加成反应,生成乙醇,反应的化学方程式为:CH2=CH2+H2O![]() CH3CH2OH。答案为:CH2=CH2+H2O
CH3CH2OH。答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(3) “腐蚀法”制作印刷电路板,是利用FeCl3的氧化性,将铜氧化为Cu2+的过程,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+。答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)铜和浓硫酸在加热条件下反应,生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是:
2![]() +KOH→
+KOH→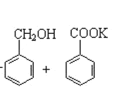 ;
;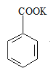 +HCl→
+HCl→![]() +KCl
+KCl
已知:①苯甲醛易被空气氧化;
②苯甲醇沸点为205.3℃;
③苯甲酸熔点为121.7℃,沸点为249℃,溶解度为0.34g;
④乙醚(C2H5OC2H5)沸点为34.8℃,难溶于水,
⑤苯甲酸钾易溶于水,可以与盐酸等强酸发生复分解反应制备苯甲酸。制备苯甲醇和苯甲酸的主要过程如下所示:
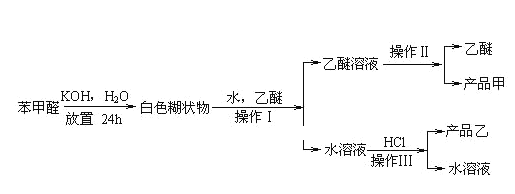
试根据上述信息回答:
(1)苯甲酸在常温下为______态,写出苯甲酸与NaOH反应的方程式:________________。
(2)操作Ⅰ的用到的主要仪器是______,乙醚溶液中所溶解的主要成分是___________。
(3)操作Ⅱ的名称是____________。收集产品甲的适宜温度为___________。
(4)操作Ⅲ的名称是_____________,产品乙是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 NaOH 和Na2CO3 混合溶液中滴加 0.1 mol·L1 稀盐酸,CO2 的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
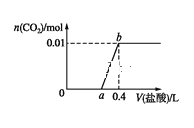
A.在 0~a 范围内,发生中和反应和 CO32-+H+=HCO3-
B.ab 段发生反应的离子方程式为: CO32-+2H+ CO2 +H2O
C.a=0.2
D.原混合溶液中NaOH 与 Na2CO3 的物质的量之比为 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是一种二元化合物,某研究小组按如图流程探究其组成,已知E是一种能够漂白品红的气体,亦能使酸性KMnO4溶液褪色。请回答:
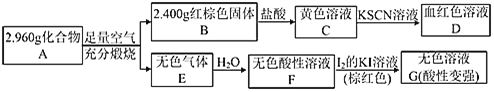
(1)某同学取少量溶液C于一支试管,加入______(填化学式)试剂无现象,可证明固体B无杂质。
(2)A的化学式为:______。
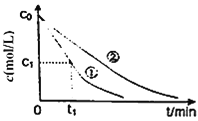
(3)溶液C可溶解铜片,若反应过程中C中某离子浓度变化如图中①所示,请写出用铜离子表达的0~t1阶段的化学反应速率:v(Cu2+)=______;相对①,②可能改变的实验条件是______。
(4)已知![]() 的KI溶液中存在平衡I2+I-
的KI溶液中存在平衡I2+I-![]() I3-,该平衡常数K的表达式为:______,在
I3-,该平衡常数K的表达式为:______,在![]() 的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
(5)F是一种二元酸H2M(M代表酸根)的溶液。T℃时,向某浓度的H2M溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2M、HM-、M2-的物质的量分数(![]() )与pH的关系如图所示:
)与pH的关系如图所示:
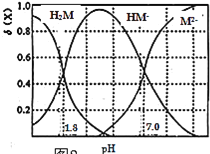
①若H2M的电离常数分别为K1与K2,则![]() ______。
______。
②按投料比n(Na2M):n(NaHM)=2:1配成溶液,下列有关该溶液的叙述正确的是______(填序号)。
A.该溶液的pH为=7.0
B.3c(Na+)+c(H+)=c(OH-)+c(HM-)+2c(M2-)
C.3c(Na+)=5[c(HM-)+c(M2-)+c(H2M)]
D.3c(OH-)+ c(M2-)=3c(H+)+2c(HM-)+5c(H2M)
(6)若F与I2的KI溶液恰好完全反应,写出反应的化学方程式______;在反应后的溶液加入足量AgNO3溶液充分反应,测得混合体系中c(I-)=amol/L,则c(SO42-)=______mol/L(已知25℃时,Ksp(AgI)=8.3×10-17,Ksp(Ag2SO4)=1.4×10-5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。

请回答:
(1) 仪器1的名称________。装置5的作用________。
(2) 实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中________。
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸热反应H2S(g)+CO2(g)![]() COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(H2S):c(CO2):c(COS):c(H2O)=1:1:1:1
D.单位时间内,断开H-S键的数目和生成H-O键的数目相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com