
【题目】吸热反应H2S(g)+CO2(g)![]() COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
COS(g)+H2O(g),若在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(H2S):c(CO2):c(COS):c(H2O)=1:1:1:1
D.单位时间内,断开H-S键的数目和生成H-O键的数目相同
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)纯碱:________,黄铁矿:_____(写化学式)
(2)乙烯和水反应的化学方程式:_____
(3) “腐蚀法”制作印刷电路板的离子方程式:______
(4)铜和浓硫酸反应化学方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
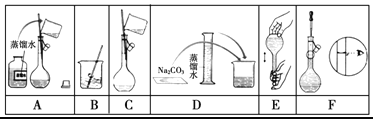
配制过程的先后顺序为(用字母A~F填写)________________。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将________(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将_______(填“偏高”、“偏低”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
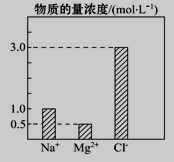
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:

(1)若X是强氧化性单质,则A不可能是____。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为____。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____;C溶液在贮存时应加入少量X,理由是(离子方程式表示)___,检验此C溶液中金属元素价态的操作方法是____。
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为____,X的化学式可能为(写出不同类物质)____或____,反应②的离子方程式为___或___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y、Z、W五种元素的原子序数依次增大,Y、Z、W的核外电子数成等差数列。已知:①Q原子的最外层电子数是次外层电子数的2倍;②Y、Z同主族,Y原子的价电子排布图为![]() 。
。
请回答下列问题:
(1)基态Q原子中,核外电子共占据了________个轨道,电子占据的最高能级符号为________,该能级被电子填满时还需要________个电子。
(2)W的元素名称为________,其基态原子的电子排布式为________。
(3)Y分别与Q、Z形成的两种三原子分子的立体构型分别为________、________;对应的中心原子的杂化类型为________、________。
(4)Q、X、Y三种元素的第一电离能按由大到小的顺序是________(填元素符号,下同),电负性由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)=Z(g)+W(g)的能量变化如图所示,下列有关该反应的说法中错误的是
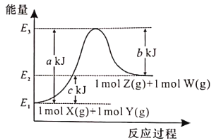
A.断开1molX(g)和1molY(g)中的化学键,要吸收akJ能量
B.1molZ(g)和1molW(g)所具有的能量为bkJ
C.每生成1molZ(g)和1molW(g)吸收ckJ能量
D.升高温度,可加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据事实,写出298K时下列反应的热化学方程式:
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为__。
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量。___。
(3)家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧反应的热化学方程式___。
(4)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用菱镁矿(主要含MgCO3,FeCO3杂质)制取碱式氯化镁[Mg(OH)Cl]的流程。已知:MgO用于调节沉淀池中溶液的pH值。
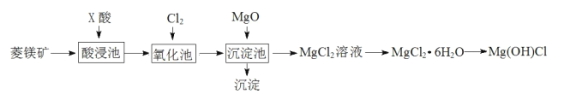
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Mg2+ | 8.8 | 11.4 |
下列说法不正确的是( )
A.酸浸池中加入的![]() 酸可以是硫酸
酸可以是硫酸
B.加入MgO后的沉淀一定含有Fe(OH)3
C.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+
D.制得碱式氯化镁的方程式为:MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com