
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
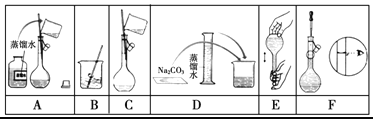
配制过程的先后顺序为(用字母A~F填写)________________。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将________(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将_______(填“偏高”、“偏低”、“不变”)。
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H___0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___molL﹣1s﹣1。

(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”或“小于”),判断理由是_______________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动。
(4)在2NO2N2O4的可逆反应中,下列状态一定属于平衡状态的是(____)
A.N2O4和NO2的分子数比为1:2 B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变D.单位时间有1molN2O4变为NO2的同时,有2molNO2变为N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2 L的密闭容器中加入1 mol CO2和3 mol H2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
CH3OH(g)+H2O(g) ΔH<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3 mol HH键断裂同时断裂3 mol HO键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氮化合物的性质叙述正确的是( )
A.可用铁制容器储存稀硝酸
B.实验室用排空气集气法收集NO气体
C.实验室可用氨水与硫酸铝溶液反应制取氢氧化铝
D.NO2与水发生化合反应生成硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率 B. 实验室用排饱和食盐水法收集氯气
C. 打开汽水瓶盖,即有大量氕泡逸出 D. 温度升高,纯水中的H+浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2等温室气体的排放所带来的温室效应已经对人类的生存环境产生很大影响。CO2的利用也成为人们研究的热点。以CO2和H2为原料合成甲醇技术获得应用。
(1)已知CH3OH (g)+![]() O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol
O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol
2H2(g)+O2(g)===2H2O(1) △H2=-571.6kJ/mol
H2O(1)====H2O(g) △H3=+44 kJ/ mol
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的反应热△H=___________。
CH3OH(g)+H2O(g)的反应热△H=___________。
(2)该反应常在230~280℃、1.5MPa条件下进行。采用催化剂主要组分为CuO-ZnO-Al2O3。催化剂活性组分为单质铜,因此反应前要通氢气还原。写出得到活性组分的反应的化学方程式:__________________________________________。使用不同催化剂时,该反应反应热△H__________(填“相同”或“不同”)
(3)该反应可以看作以下两个反应的叠加:
CO2(g)+H2(g)![]() CO(g)+H2O(g),平衡常数K1;
CO(g)+H2O(g),平衡常数K1;
CO(g)+2H2(g)![]() CH3OH(g),平衡常数K2;
CH3OH(g),平衡常数K2;
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=___________(用含K1、K2的代数式表示)
CH3OH(g)+H2O(g)的平衡常数K=___________(用含K1、K2的代数式表示)
(4)反应过程中,发现尾气中总会含有一定浓度的CO,为了减少其浓度,可以采取的措施为_________________________________(写一条即可)
(5)为了提高反应速率,采取的措施可以有___________。
A.使用高效催化剂 B.在较高压强下进行 C.降低压强 D.充入高浓度CO2
(6)有人研究了用电化学方法把CO2转化为CH3OH,其原理如图所示:
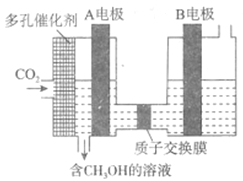
则图中A电极接电源___________极。已知B电极为惰性电极,则在水溶液中,该极的电极反应为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com