
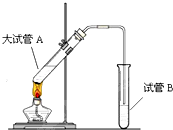
 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:分析 (1)乙酸与乙醇在浓硫酸做催化剂、吸水剂作用下加热生成乙酸乙酯;乙酸、乙醇易挥发,制备的乙酸乙酯中含有乙醇和乙酸,依据乙醇易溶于水,乙酸能够与碳酸钠溶液反应的性质判断碳酸钠的作用;导管伸入液面下可能发生倒吸;
(2)乙酸与乙醇在浓硫酸做催化剂、吸水剂作用下加热生成乙酸乙酯和水,据此书写方程式;
(3)酯化反应为可逆反应,该反应达到平衡状态时一定满足正逆反应速率相等、各组分的浓度不变,据此对各选项进行判断;
(4)浓硫酸具有脱水性容易使乙醇、乙酸发生脱水反应生成黑色碳,与炭反应生成二氧化硫污染气体.
解答 解:(1)乙酸与乙醇在浓硫酸做催化剂、吸水剂作用下加热生成乙酸乙酯;
制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,便于闻乙酸乙酯的香味;
导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;
故答案为:催化剂;饱和碳酸钠溶液;吸收乙醇,中和乙酸,降低乙酸乙酯的溶解度;倒吸;
(2)乙酸与乙醇在浓硫酸做催化剂、吸水剂作用下加热生成乙酸乙酯和水,方程式为:CH3COOH+C2H5OH$?_{加热}^{浓硫酸}$CH3COOC2H5+H2O;
故答案为:CH3COOH+C2H5OH$?_{加热}^{浓硫酸}$CH3COOC2H5+H2O;
(3))①化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间里,生成1mol乙酸乙酯,同时生成1mol水,故①错误;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;
③表示的都是正反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故③错误;
④混合物中各物质的浓度不再变化,说明达到平衡状态,故④正确;
故答案为:②④;
(4)A、浓硫酸是难挥发性酸,故A不符合;
B、会使部分原料乙酸、乙醇炭化,故B符合;
C、浓硫酸的吸水性是有利于酯化反应.促进平衡正向进行,故C不符合;
D、浓硫酸和碳等物质反应生成二氧化硫等污染气体,造成环境污染,故D符合;
故答案为:BD.
点评 本题考查了乙酸乙酯的制取方法、化学平衡状态的判断,题目难度中等,注意掌握酯化反应原理及实验操作方法方法,明确化学平衡状态的特征及判断方法.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 参考如图,按要求回答下列问题:
参考如图,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | Cu(OH)2+2HCl═CuCl2+2H2O | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com