
分析 (1)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)反应热;平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
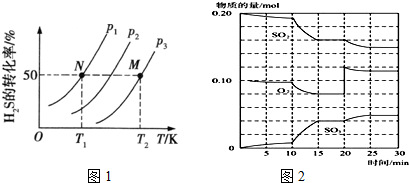
(2)H2S气体分解生产H2和S2(g)的反应为2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,反应前后气体体积增大,同温度下,压强越大,平衡逆向进行,H2S转化率减小,温度升高,H2S的转化率增大,说明正反应为吸热反应,升温平衡正向进行,平衡常数增大;
(3)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态;
②由图可知,反应进行至20min时,改变体积,平衡向正反应移动,瞬间只有氧气的浓度增大;由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变;
(4)依据溶液中存在的电荷守恒分析;
解答 解:(1)①CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H=+210.5kJ•mol-1
②$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H=-47.3kJ•mol-1
利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=4×(-47.3kJ•mol-1)-(210.5kJ•mol-1)=-399.7kJ•mol-1,平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)c(S{O}_{2})}$,
故答案为:-399.7;$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)c(S{O}_{2})}$;
(2)H2S气体分解生产H2和S2(g)的反应为2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,反应前后气体体积增大,同温度下,压强越大,平衡逆向进行,H2S转化率减小,则P1<P2<P3,温度升高,H2S的转化率增大,说明正反应为吸热反应,升温平衡正向进行,平衡常数增大,K(T1)<K(T2),
故答案为:P1<P2<P3;反应前后气体体积增大,增大压强平衡逆向进行;<;反应是吸热反应,升温平衡正向进行,平衡常数增大;
(3)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,
故答案为:15-20min和25-30min;
②由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度.由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO2的物质的量,故d错误;
故答案为:增大氧气的浓度;ab;
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),
故答案为:2c(SO32-)+c(HSO3-).
点评 本题考查了热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,掌握基础是关键,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯、苯与硝酸作用得到一硝基取代物的反应条件分别为30℃、50-60℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| C. | 0.5 mol•L-1MgCl2溶液中,含有Cl-个数为NA | |
| D. | 18 g NH4+中所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(6) | C. | (1)(2)(5)(6) | D. | (1)(3)(6)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol Al与足量盐酸反应转移电子数为1NA | |
| B. | 500mL 1mol/LNa2CO3溶液中,含有Na+离子数目为NA | |
| C. | 常温常压下,11.2LO2(g)中含有O2分子数目为0.5NA | |
| D. | 标准状况下,11.2 L H2O所含的分子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com