
【题目】MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
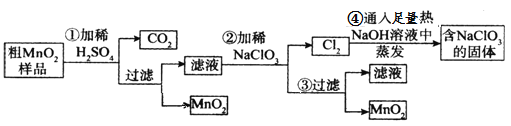
回答下列问题:
(1)第②步操作中,氧化性强弱顺序:ClO3-________(填“>”或“<”)MnO2,当NaClO3转移2 mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_____(填字母)。
a. NaCl b. NaClO c. NaClO4 d. NaOH
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____________。
(4)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的方程式为:8HClO3 = 3O2 ↑+ 2Cl2 ↑+ 4HClO4 + 2H2O,所得混合气体的平均式量为_______。
【答案】> 1 ClO3-+5Cl-+6H+=3Cl2↑+3H2O ad 2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+ 47.6
【解析】
粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,据此分析解答。
(1)第②步中的反应为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3的物质的量=![]() =0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,故答案为:>;1;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
=0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,故答案为:>;1;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(2)第④步操作中NaOH过量,发生的反应为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,则最终得到的固体除NaClO3外,还有NaOH和NaCl,故答案为:ad;
(3)锰离子失电子被氧化生成高锰酸根离子,所以锰离子作还原剂,氧化剂得电子化合价降低,IO3-和IO4-中碘元素的化合价分别是+5价和+7价,所以IO4-作氧化剂,还原产物是IO3-,同时水参加反应生成氢离子,所以该反应的离子方程式为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,故答案为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+;
(4)8HClO3 = 3O2 ↑+ 2Cl2 ↑+ 4HClO4 + 2H2O反应中混合气体中氧气和氯气的体积之比为3∶2,混合气体的平均式量 =![]() =47.6,故答案为:47.6。
=47.6,故答案为:47.6。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答有关问题。
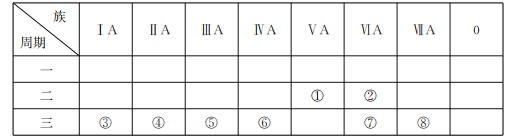
(1)写出元素符号:①___,⑥___。
(2)在这些元素中,最活泼的金属元素的原子结构示意图为___。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生反应的离子方程式为___。
(4)在②、③、④、⑤这些元素形成的最简单离子中,离子半径由大到小的顺序为___(填离子符号)。
(5)由元素②、③、⑧形成的一种常见的杀菌消毒剂中存在的化学键有___。
(6)由元素⑦和⑧形成的某种化合物可表示为X2Y2(其中各原子均满足8电子稳定结构),写出X2Y2的电子式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
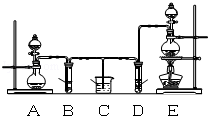
(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)△MnCl2+2H2O+Cl2↑,应选用图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 .
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 .
(3)写出过量NaOH溶液与SO2气体反应的离子方程式是 .
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
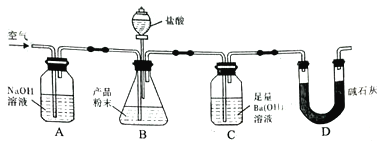
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4的下列说法中错误的是
A. CuSO4在反应中被还原
B. FeS2既是氧化剂也是还原剂
C. 14 mol CuSO4氧化了1 mol FeS2
D. 被还原的S和被氧化的S的质量之比为3∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料认为NO不能与Na2O2反应。有同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。
查阅资料:a.2NO+Na2O2=2NaNO2
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O
c.酸性条件下,NO能被MnO4-氧化成NO3-
该同学利用如图中装置来探究NO与Na2O2的反应(装置可重复使用)。
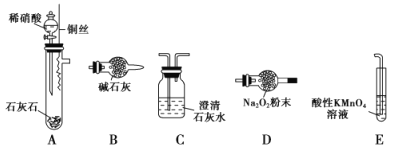
(1)装置连接的顺序为A→_______________,A中生成NO的化学方程式____________;
(2)装置C的作用是_________________;
(3)装置E的作用是_________________,发生反应的离子方程式为______________;
(4)充分反应后,检验D装置中是否生成了NaNO2的实验操作是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
A. 接近称量质量时,轻振手腕,加够药品
B. 溶解时,用量筒控制所加蒸馏水的量
C. 移液时,玻璃棒插在刻度线上,防止液体洒出![]()
D. 接近刻度线1~2cm时,用胶头滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机化合物A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。
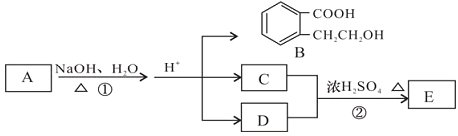
请回答下列问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为_________________。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为_________________。
(3)D也可以由溴代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式_________________。
(4)反应①的化学方程式_________________。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式:_________________。
a.能够发生水解
b.能发生银镜反应
c.能够与FeCl3溶液显紫色
d.苯环上的一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池领域作出巨大贡献的三位科学家。某锂离子电池以![]() 为负极,
为负极,![]() 为正极,锂盐有机溶液作电解质溶液,电池反应为
为正极,锂盐有机溶液作电解质溶液,电池反应为![]() 。则下列有关说法正确的是( )
。则下列有关说法正确的是( )
A.金属锂的密度、熔点和硬度均比同族的碱金属低
B.该锂离子电池可用乙醇作有机溶剂
C.电池放电时,![]() 从正极流向负极
从正极流向负极
D.电池充电时,阳极的电极反应式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com