
【题目】将一定质量Fe、Fe2O3和CuO的混合粉末投入到100 mL 1.80 molL-1的硫酸中,充分反应后收集到标准状况下0.896 L H2,又测得反应后的混合体系中只有FeSO4溶液和1.28 g固体Cu。请你确定原混合粉末中Fe的质量_____________。(要求写出简要推理过程)
【答案】5.60 g
反应后的溶液中仅有FeSO4,据此可求出Fe元素的总量为0.18mol;固体混合物与硫酸反应时,还原剂仅Fe单质,氧化剂则有Fe2O3,CuO以及硫酸中的一部分H+,并且可以根据题中的信息直接求出CuO的量为0.02mol以及起氧化作用的H+的量为0.04×2=0.08mol,再结合求出的Fe元素的总量,设Fe的量为x,列反应过程中的电子得失守恒式:![]() ,即可求出Fe为0.1mol,质量即为5.60g。
,即可求出Fe为0.1mol,质量即为5.60g。
【解析】
反应后的溶液中只有FeSO4,即硫酸恰好反应完,所以根据硫酸的物质的量可知,固体混合物中Fe元素总量为:![]() ;反应前的固体中Fe有两种形式一种是Fe单质,一种是Fe2O3,说明反应过程中Fe单质全部被氧化为Fe2+,Fe3+全部被还原为Fe2+;固体混合中Cu是以CuO的形式存在,反应后也全被还原为Cu单质;此外,固体混合物与硫酸反应时还生成了标况下0.896LH2即0.04mol,这来源于H+被还原。因此,铁单质转移的电子的物质的量与Fe2O3,CuO以及H+被还原转移的电子的物质的量相等,假设混合物中铁的物质的量为xmol,列电子得失守恒式:
;反应前的固体中Fe有两种形式一种是Fe单质,一种是Fe2O3,说明反应过程中Fe单质全部被氧化为Fe2+,Fe3+全部被还原为Fe2+;固体混合中Cu是以CuO的形式存在,反应后也全被还原为Cu单质;此外,固体混合物与硫酸反应时还生成了标况下0.896LH2即0.04mol,这来源于H+被还原。因此,铁单质转移的电子的物质的量与Fe2O3,CuO以及H+被还原转移的电子的物质的量相等,假设混合物中铁的物质的量为xmol,列电子得失守恒式:![]() ,解得x=0.10mol,即Fe的质量为5.60g。
,解得x=0.10mol,即Fe的质量为5.60g。


科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列填空。
(1)a.金刚石和石墨 b.12C和13C c.CH4和C2H6 d.乙醇与二甲醚(填字母)
①互为同位素的是___;
②互为同素异形体的是___;
③互为同系物的是___;
④互为同分异构体的是___。
(2)请补充完下列方程式:
①CH4+Cl2![]() ___+HCl
___+HCl
②CH2=CH2+Br2→___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应H2CO3![]() HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
A.正常人血液内Kw=10-14
B.由题给数据可算得正常人血液的pH约为7.4
C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)
D.当过量的碱进入血液中时,只有发生HCO3-+OH-=CO32-+H2O的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,下列说法错误的是( )
实验 序号 | 实验温度T/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间t/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 4 | 0.02 | 6 | 0.1 | 0 | 6 |
B | 293 | 4 | 0.02 | 4 | 0.1 | V1 | 8 |
C | T1 | 4 | 0.02 | 6 | 0.1 | 0 | 5 |
A.时间t的意义是,从溶液混合到KMnO4颜色褪去的时间
B.实验C中5s内平均反应速率v(KMnO4)=1.6×10-3molL-1s-1
C.实验A和B是探究
D.实验A和C是探究温度对反应速率的影响,则T1>293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物G,其合成路线如下:
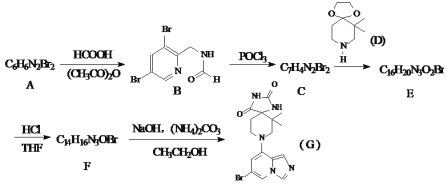
已知:①R-X+ ![]() ②
② ![]()
试回答下列问题:
(1)写出A的结构简式_________。
(2)下列说法正确的是__________
A.化合物E具有碱性 B.化合物B与新制氢氧化铜加热产生砖红色沉淀
C.化合物F能发生还原反应 D.化合物G的分子式为C16H17N5O2Br
(3)写出C+D→E的化学方程式___________。
(4)请设计以用4-溴吡啶(![]() )和乙二醇(
)和乙二醇(![]() )为原料合成化合物D的同系物
)为原料合成化合物D的同系物![]() 的合成路线________(用流程图表示,无机试剂任选)。
的合成路线________(用流程图表示,无机试剂任选)。
(5)写出化合物A可能的同分异构体的结构简式__________。
须同时符合:①分子中含有一个苯环; ②1H-NMR图谱显示分子中有3种氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
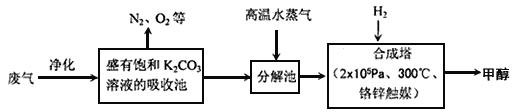
⑴合成塔中反应的化学方程式为_________;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了_____。
(2)从合成塔分离出甲醇的原理与下列_______操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_____。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为________。
(2)下列描述能说明反应达到平衡的是_______
A.装置内气体颜色不再改变 B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变 D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)
Ⅲ. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
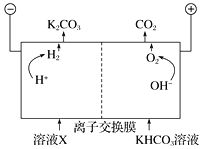
①在阳极区发生的反应包括_________和H++HCO![]() ===H2O+CO2↑。
===H2O+CO2↑。
②简述CO32-在阴极区再生的原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物1是一种常见的植物两味油,常用脂肪烃A和芳香烃D按如下路线合成:

已知:①R1CHO+R2CH2CHO![]()

![]()

②通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的名称是___,H含有的官能团名称是_____。
(2)②的反应条件是___。⑦的反应类型是______。
(3)I的结构简式是________。
(4)④的化学方程式是_________。
(5)L是I的同分异构体且含有相同官能团,其结构中苯环上只有两个处于对位的取代基,则L共有_种(不考虑立体异构)
(6)参照以上合成路线,设计以C为原料制备保水树脂 的合成路线(无机试剂任选)__ 。
的合成路线(无机试剂任选)__ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的装置,验证氨气的喷泉实验。回答下列问题:
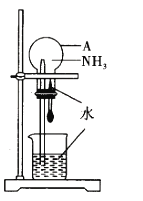
(1)仪器A的名称是_________________。
(2)写出实验室用NH4Cl和Ca(OH)2制氨气的化学方程式:___________________。
(3)喷泉实验前需要在仪器A中充满干燥的氨气。
①可用向____________填“上”或“下”)排空气法收集氨气。
②下列物质可用于干燥氨气的是__________(填序号)。
A. 浓硫酸 B. 碱石灰 C. 浓硝酸
(4)NH3能在水中进行喷泉实验的原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com