
【题目】某同学利用如图所示的装置,验证氨气的喷泉实验。回答下列问题:
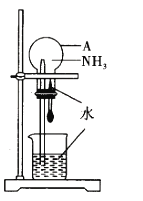
(1)仪器A的名称是_________________。
(2)写出实验室用NH4Cl和Ca(OH)2制氨气的化学方程式:___________________。
(3)喷泉实验前需要在仪器A中充满干燥的氨气。
①可用向____________填“上”或“下”)排空气法收集氨气。
②下列物质可用于干燥氨气的是__________(填序号)。
A. 浓硫酸 B. 碱石灰 C. 浓硝酸
(4)NH3能在水中进行喷泉实验的原因是__________________。
【答案】圆底烧瓶 2 NH4Cl + Ca(OH)2 ![]() CaCl2+ 2 NH3↑+ 2 H2O 下
CaCl2+ 2 NH3↑+ 2 H2O 下
B NH3极易溶于水,使烧瓶内外瞬间产生压强差
【解析】
(1)根据装置特点,仪器A的名称为圆底烧瓶;
(2)实验室用NH4Cl和Ca(OH)2在加热的条件下生成氯化钙、氨气和水,方程式为2 NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)①氨气的密度比空气小,可采用瓶口向下的方法收集;
②碱石灰不与氨气反应,且能吸收水,可干燥氨气;浓硫酸、浓硝酸均与氨气反应,不能干燥氨气,答案为B。
(4)NH3极易溶于水,氨气溶于水后,在装置内产生压强差,导致烧杯中的水迅速进入烧瓶,形成喷泉。


科目:高中化学 来源: 题型:
【题目】将一定质量Fe、Fe2O3和CuO的混合粉末投入到100 mL 1.80 molL-1的硫酸中,充分反应后收集到标准状况下0.896 L H2,又测得反应后的混合体系中只有FeSO4溶液和1.28 g固体Cu。请你确定原混合粉末中Fe的质量_____________。(要求写出简要推理过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将25℃时浓度均为0.1mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图所示。下列说法错误的是( )
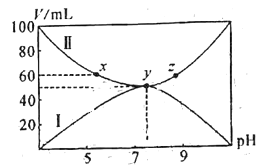
A.曲线II表示HA溶液的体积
B.x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C.电离平衡常数:K(HA)>K(BOH)
D.x、y、z三点对应的溶液中,y点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:
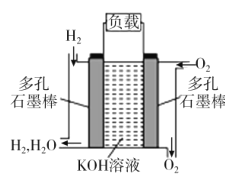
(1)写出氢氧燃料电池工作时的正极反应式:___。
(2)该氢氧燃料电池每转移0.1mo1电子,消耗标准状态下___L氧气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法正确的是( )
A.30g醋酸和葡萄糖的混合物中,碳原子数的数目为NA
B.标准状况下,2.24 L CHCl3含有的共价键数为 0.4NA
C.常温下,2.8 g C2H4与CO的混合气体所含碳原数为 0.3NA
D.0.1mol/L Na2S 溶液中,S2- 、HS- 、H2S的数目共为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
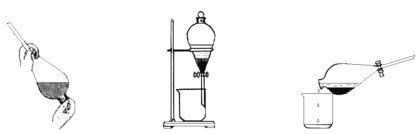
甲.加入萃取剂后振荡 乙.静置分层 丙.分离
①该同学所采用的萃取剂可能是______(填“A”、“B”或“C”)。
A.酒精 B.苯 C.四氯化碳
②甲、乙、丙3步实验操作中,不正确的是______(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:
A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式___。
(2)CN-中碳原子的杂化方式为___。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为___。
(4)写出一种与SCN-互为等电子体的分子___。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。

(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体表面化学对于化学工业很重要,有助于了解诸如钢铁为什么生锈、燃料电池如何工作、汽车尾气处理时催化剂的工作原理等。下列涉及该研究的项目中,说法正确的是
A.纯铁比生铁更易生锈
B.硝酸工业中,NH3和O2在铂系催化剂表面生成NO和H2O
C.氢氧燃料电池中,燃料在正极失去电子被氧化
D.臭氧层的破坏主要与CO2排放有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如图:
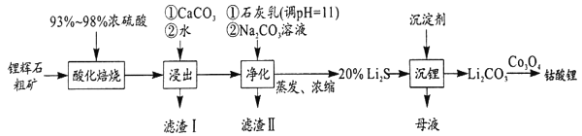
已知:Ksp[Mg(OH)2]=10-11,Ksp[Al(OH)3]=10-33,Ksp[Fe(OH)3]=10-38
回答下列问题:
(1)为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈__,可以认为该矿石中存在锂元素。
a.紫红色 b.紫色 c.黄色
(2)锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为__。
(3)为提高“酸化焙烧”效率,常采取的措施是__。
(4)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为__。(已知:完全沉淀后离子浓度低于1×l05)mol/L)
(5)“滤渣Ⅱ”的主要化学成分为___。
(6)“沉锂”过程中加入的沉淀剂为饱和的__溶液(填化学式);该过程所获得的“母液”中仍含有大量的Li+,可将其加入到“__”步骤中。
(7)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com