
| ||
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
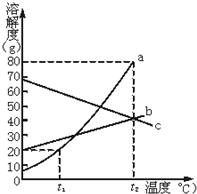 根据溶解度曲线回答问题.
根据溶解度曲线回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3在水溶液中的电离:NaHCO3?Na++H++CO32- |
| B、水溶液中HS一发生水解:HS-+H2O?H3O++S2- |
| C、氢氧燃料电池碱性介质中正极反应式:O2+2H2O+4e-=4OH- |
| D、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在C60和K3C60中,碳元素分别以游离态和化合态存在 |
| B、C60是一种含碳化合物 |
| C、等质量的C60和金刚石含碳原子数目相同 |
| D、C60与石墨互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com