
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A. A﹥B﹥E﹥D B. A﹥B﹥D﹥E C. D﹥E﹥A﹥B D. D﹥A﹥B﹥E
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
以下有关物质的质量分数和物质的量浓度的叙述正确的是
A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡
沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B.Na 2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10%
D.20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数
为 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色。下列说法正确的是( )
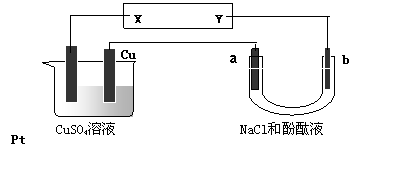
A.NaCl溶液浓度不变 B.X是负极,Y是正极
C.CuSO4溶液浓度变小 D.X是正极,Y是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热
B.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同
C.稀溶液中:H+(aq)+OH—(aq) ===H2O(l);ΔH=—53.7KJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7KJ
D.由C(石墨)=== C(金刚石) △H= +1.90 kJ·mol-1 可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
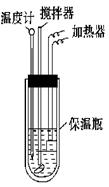 在量热计中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。
在量热计中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。
(1)该反应的热化学方程式为 。
(2)在做中和反应的反应热的测定实验时,下列操作错误的是
A. 测量溶液的温度计要一直插在溶液中B. 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
C. 为了使反应进行更完全,可以是酸(碱)适当过量
D. 若用KOH代替NaOH,对测定结果有影响。
(3) 你认为CH3COOH的中和热与HCl的中和热数值相比,________较大,其原因是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com