
| 选项 | ① | ② | ③ | 实验结论 | 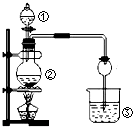 |
| A | 浓盐酸 | MnO2 | NaBr | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO4 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、白色沉淀不含BaSO3 |
| B、溶液的酸性减弱 |
| C、白色沉淀是BaSO4 |
| D、FeCl3全部被还原为FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
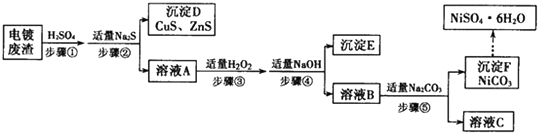
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+ Na+NO3- Cl- |
| B、K+ Na+Cl- NO3- |
| C、K+ Na+ Cl-AlO2- |
| D、K+ NH4+ SO42-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将FeCl3溶液滴入蒸馏水中即可 |
| B、将FeCl3溶液滴入热水中,得到黄色液体即可 |
| C、将FeCl3溶液滴入沸水中,得到红褐色液体即可 |
| D、将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 |
| B、可用四氯化碳萃取溴水中的溴 |
| C、在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D、作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理量 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | |||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | |||
| ① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| ② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.010 | 4.0 | 25 | |||
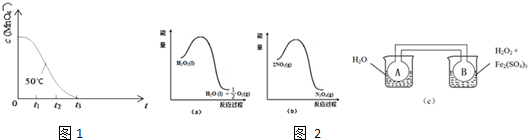
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com