
| A、白色沉淀不含BaSO3 |
| B、溶液的酸性减弱 |
| C、白色沉淀是BaSO4 |
| D、FeCl3全部被还原为FeCl2 |


科目:高中化学 来源: 题型:
| A、标准状况下,40g SO3的体积为11.2L | ||||
| B、高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3 NA | ||||
C、5NH4NO3
| ||||
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
| o2 |
| o2 |
| H2o |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④⑥ |
| C、②③④⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 宇宙中含量最高的元素 |
| B | 2P轨道有一对成对电子 |
| C | 第一电离能比左右相邻元素小 |
| D | 单质为黄色固体,是古代黑火药的主要成分之一 |
| E | 位于周期表的第11列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | ① | ② | ③ | 实验结论 | 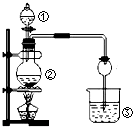 |
| A | 浓盐酸 | MnO2 | NaBr | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO4 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com