
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
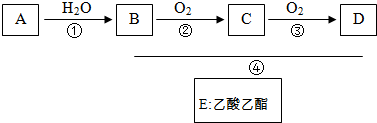
| o2 |
| o2 |
| H2o |
 ,故答案为:
,故答案为: ;
;  故答案为:
故答案为: ;
;

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、析出0.2molCu |
| B、剩余0.1molFe |
| C、没有金属析出 |
| D、剩余0.1mol的Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
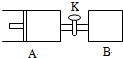 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=2PA |
| D、平衡时Y的体积分数:A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
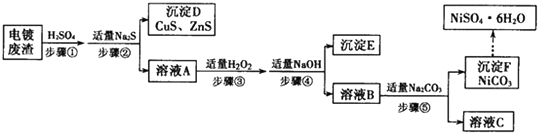
| A、白色沉淀不含BaSO3 |
| B、溶液的酸性减弱 |
| C、白色沉淀是BaSO4 |
| D、FeCl3全部被还原为FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com