
����Ŀ����������������ɴ�����Ⱦ����Ҫ���ʡ��о���������ķ�Ӧ������������������Ⱦ����Ҫ���塣NO�ڿ����д������·�Ӧ��2NO(g)+ O2(g)![]() 2NO2(g) ��H������Ӧ��������ɣ���ͼ1��ʾ��
2NO2(g) ��H������Ӧ��������ɣ���ͼ1��ʾ��
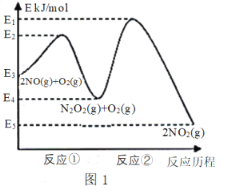
�ش��������⣺
(1)д����Ӧ�ٵ��Ȼ�ѧ����ʽ(��H�ú�������E�ĵ�ʽ��ʾ)��___________��
(2)��Ӧ�ٺͷ�Ӧ���У�һ���ǿ췴Ӧ������ٽ���ƽ��״̬������һ��������Ӧ������2NO(g)+O2(g)![]() 2NO2(g)��Ӧ���ʵ���_______(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������_________(��Ӧδʹ�ô���)��
2NO2(g)��Ӧ���ʵ���_______(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������_________(��Ӧδʹ�ô���)��
(3)T1�¶�ʱ���ݻ�Ϊ2L�ĺ����ܱ�������ֻ����1.00molNO2���巢����Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)�����
2NO2(g)��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
�ٴ�0��2s�÷�Ӧ��ƽ������v(NO2)=___________mol/(L��s)��
��T1�¶�ʱ��ѧƽ�ⳣ��K=___________mol��1��L��
�ۻ�ѧƽ�ⳣ��K�����ʳ���k����k������ѧ��ϵ��K=___________�������������¶ȸı�ΪT2ʱ��k��=k������T1__________T2 (����>������<������=��)��
���𰸡�2NO(g) ![]() N2O2(g) ��H = -(E3-E4) kJ/ mol ��Ӧ�� �����ܷ�Ӧ���ʵ��Ƿ�Ӧ�ڣ��¶����ߺ�Ӧ��ƽ�������ƶ������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬N2O2Ũ�ȼ�С���·�Ӧ�����ʱ��� 0.0875 8 k��/k�� <
N2O2(g) ��H = -(E3-E4) kJ/ mol ��Ӧ�� �����ܷ�Ӧ���ʵ��Ƿ�Ӧ�ڣ��¶����ߺ�Ӧ��ƽ�������ƶ������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬N2O2Ũ�ȼ�С���·�Ӧ�����ʱ��� 0.0875 8 k��/k�� <
��������
��1������ͼ���֪��Ӧ��Ϊ2NO��g��N2O2��g�������ʱ��H=��E2-E3��kJ/mol��
��2������ͼ���֪����Ӧ�ٵĻ��<��Ӧ�ڵĻ�ܣ���Ӧ��Ϊ�췴Ӧ����Ӧ��Ϊ����Ӧ�������÷�Ӧ���ʵ�������Ӧ��
��������Ӧ���ʵ��Ƿ�Ӧ�ڣ������¶Ⱥ�Ӧ��ƽ�������ƶ������N2O2Ũ�ȼ�С�����¶����߶�Ӧ��Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ�죻
��3������v=��c/��t�����ǰ5s��v��NO2����֮��v��O2��=1/2v��NO2�����㣻
2NO2��g��2NO��g��+O2��g��
��ʼ��mol/L��0.04 0 0
ת����mol/L��0.02 0.02 0.01
ƽ�⣨mol/L��0.02 0.02 0.01
���¶��¸÷�Ӧ��ƽ�ⳣ��K=0.022��0.01/0.022=0.01��2NO+O22NO2�Ļ�ѧƽ�ⳣ����2NO2��g��2NO��g��+O2��g����ƽ�ⳣ����Ϊ������
(1)����ͼ���֪��Ӧ�ٵĻ�ѧ����ʽΪ��2NO(g)N2O2(g)��H=(E2E3)kJ/mol��
�ʴ�Ϊ��2NO(g)N2O2(g)��H=(E2E3)kJ/mol��
(2)����ͼ���֪,��Ӧ�ٵĻ��<��Ӧ�ڵĻ��,��Ӧ��Ϊ�췴Ӧ,��Ӧ��Ϊ����Ӧ,����2NO(g)+O2(g)2NO2(g)��Ӧ���ʵ�������Ӧ�ڣ�
�Ը÷�Ӧ���������¶�,�����ܷ�Ӧ���ʱ���,����ԭ���ǣ���������Ӧ���ʵ��Ƿ�Ӧ��,�����¶Ⱥ�Ӧ��ƽ�������ƶ�,���N2O2Ũ�ȼ�С,�¶����߶�Ӧ��Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ��,N2O2Ũ�ȼ�С���·�Ӧ�����ʱ�����
�ʴ�Ϊ����Ӧ��;��������Ӧ���ʵ��Ƿ�Ӧ��,�����¶Ⱥ�Ӧ��ƽ�������ƶ�,���N2O2Ũ�ȼ�С,�¶����߶�Ӧ��Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ��,N2O2Ũ�ȼ�С���·�Ӧ�����ʱ�����
(3)ǰ5s��v(NO2)=0.04mol/L0.03mol/L5s=0.002mol/(Ls),
��v(O2)=12v(NO2)=0.001mol/(Ls)��
2NO2(g)2NO(g)+O2(g)
��ʼ(mol/L)0.04 1 0
ת��(mol/L)0.02 0.35 0.35
ƽ��(mol/L)0.02 0.65 0.35
��0��2s�÷�Ӧ��ƽ������v(NO2)=0.35/2/2=0.0875 mol/(L��s)
�ʴ�Ϊ��0.0875 mol/(L��s)
�� ��Ӧ���д�4-5��ʱ�ﵽƽ��״̬
2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
��ʼ(mol/L)0.04 0 0 1
ת��(mol/L)0.02 0.50 0.25 0.50
ƽ��(mol/L)0.02 0.5 0.25 0.50
�ij�Ũ��Ϊ 0.25 0.125 0.25
���¶��¸÷�Ӧ��ƽ�ⳣ��K=0.25��0.25/0.25��0.25��0.125=8
��2NO+O22NO2�Ļ�ѧƽ�ⳣ��K==8��
�ʴ�Ϊ��8
������v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ��
��ѧƽ�ⳣ��K�����ʳ���k����k������ѧ��ϵ��K= k��/k��
�����������¶ȸı�ΪT2ʱ��k��=k������ƽ�������ƶ�����T1<T2
�ʴ�Ϊ��k��/k�棻T<T



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ�ܴ����������
A.pH��1����Һ�У�Fe2����NO3-��SO42-��Na��
B.��ˮ�����c(H��)��1��10��14mol��L��1����Һ�У�Ca2����K����Cl����HCO3-
C.![]() ��1012����Һ�У�NH4+��Al3����NO3-��Cl��
��1012����Һ�У�NH4+��Al3����NO3-��Cl��
D.c(Fe3��)��0.1 mol��L��1����Һ�У�K����ClO����SO42-��SCN��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������N2O5ʱ����������������Ӧ��N2O5(g)![]() N2O3(g)��O2(g)��N2O3(g)
N2O3(g)��O2(g)��N2O3(g)![]() N2O(g)��O2(g)����1L�ܱ���������4mol N2O5���ﵽƽ��ʱ��c(O2)Ϊ4.5mol��L��1��c(N2O3)Ϊ1.62mol��L��1����c(N2O5)Ϊ
N2O(g)��O2(g)����1L�ܱ���������4mol N2O5���ﵽƽ��ʱ��c(O2)Ϊ4.5mol��L��1��c(N2O3)Ϊ1.62mol��L��1����c(N2O5)Ϊ
A. 1.44mol��L��1 B. 3.48mol��L��1 C. 0.94mol��L��1 D. 1.98mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧʵ���г������Ʊ����岢����ijЩ���ʵļ��������ʵ���װ�ã�A���Ʊ������װ�ã�C��D��E��F��ʢװ��Һ�������ͬ��Ҳ���ܲ�ͬ���Իش�
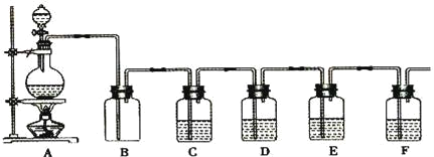
��1�����A�еĹ���������̼����Һ©����ʢװ����Ũ���ᣬ��д�������Ļ�ѧ��Ӧ����ʽ��____����Ҫ�������ɵIJ����B��C��D��E��F��Ӧ�ֱ������Լ�Ϊ__��__��__��__��__��E���Լ���C����ͬ��E���Լ����������__��Bװ�ó��ɼ��ij�����⣬������__���á�
��2������������ʵ��ʱ��F�еõ�10.0 g���壬��A�з�����Ӧת�Ƶĵ�����Ϊ__����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T��ʱ����1 L�̶�������ܱ�����M�м���2 mol X��1 mol Y���������·�Ӧ��2X(g)��Y(g) ![]() aZ(g)��W(g)����H����Q kJ/mol(Q>0)���÷�Ӧ�ﵽƽ��ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����ش��������⣺
aZ(g)��W(g)����H����Q kJ/mol(Q>0)���÷�Ӧ�ﵽƽ��ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����ش��������⣺
(1)��ѧ������a��ֵΪ________��
(2)������˵���÷�Ӧ�ﵽ�˻�ѧƽ��״̬����________(�����)��
a��������ѹǿһ�� b��������������ܶ�һ��
c��������Z�ķ�����һ�� d�����������������һ��
(3)ά��T���¶Ȳ��䣬����ʼʱ������M�м���2 mol X��1 mol Y��1 mol Ar(ϡ�����岻���뷴Ӧ)����Ӧ�ﵽƽ���ų���������________kJ��
(4)ά��T���¶Ȳ��䣬����һ����ԭ���������ȵĺ�ѹ����N�м���2 mol X��1 mol Y�����������Ӧ���ﵽƽ�⣬��________(����M������N��)�����еķ�Ӧ�ȴﵽƽ��״̬��������X����������M________N(����>������<����������)��
(5)��֪���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��������ʾ��
�¶�/�� | 200 | 250 | 300 | 350 |
ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0.5 |
����ij�¶��£�2 mol X��1 mol Y������M�з�Ӧ���ﵽƽ�⣬X��ƽ��ת����Ϊ50%������¶�Ϊ________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼���������Ԫ�ػ���������ʻ�ת���Խ�����̬�����������й�������Ҫ���塣
(1)��ˮ����̼�Ĵ�����ʽ���ֲ���ͼ��ʾ��
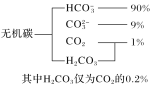
�����ӷ���ʽ��ʾ��ˮ�������Ե�ԭ��______________����֪������ˮpH��8.1��Ԥ���ļ���ˮ���Խ���_____________(���ǿ��������)��
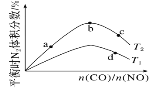
(2)��ҵ����CO��H2Ϊԭ�Ϻϳɼ״��ķ�Ӧ��
CO(g)��2H2(g)![]() CH3OH(g)����H��0�����ݻ�Ϊ1 L�ĺ��������У��ֱ���T1��T2��T3�����¶��ºϳɼ״�����ͼ�����������¶��²�ͬH2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ������˵����ȷ����________(����ĸ)��
CH3OH(g)����H��0�����ݻ�Ϊ1 L�ĺ��������У��ֱ���T1��T2��T3�����¶��ºϳɼ״�����ͼ�����������¶��²�ͬH2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ������˵����ȷ����________(����ĸ)��
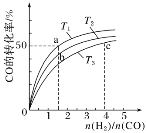
A��a��b��c����H2ת���ʣ�c��a��b
B�����������¶�֮���ϵΪT1��T2��T3
C��a��״̬����ͨ��0.5 mol CO��0.5 mol CH3OH��ƽ�ⲻ�ƶ�
D��c��״̬����ͨ��1 mol CO��4 mol H2����ƽ����H2�������������
(3)NO���ٳ����㱻�ƻ����䷴Ӧ��������ͼ��ʾ��
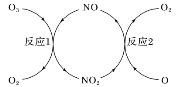
��NO��������___________________��
����֪��
O3(g)��O(g)=2O2(g)����H����143 kJ��mol��1
��Ӧ1��O3(g)��NO(g)=NO2(g)��O2(g)����H1����200.2 kJ��mol��1��
��Ӧ2���Ȼ�ѧ����ʽΪ______________________��
(4)����CO��NO����ͬ����Ͷ��һ�ܱ������з�����Ӧ��2CO(g)��2NO(g)![]() N2(g)��2CO2(g)����H����759.8 kJ��mol��1����Ӧ�ﵽƽ��ʱ��N2�����������
N2(g)��2CO2(g)����H����759.8 kJ��mol��1����Ӧ�ﵽƽ��ʱ��N2�����������![]() �ı仯��������ͼ��
�ı仯��������ͼ��
��b��ʱ��ƽ����ϵ��C��Nԭ�Ӹ���֮�Ƚӽ�________��
��a��b��c����CO��ת���ʴӴ�С��˳��Ϊ________��a��c��d�����ƽ�ⳣ���Ӵ�С��˳��Ϊ__________��
����![]() ��0.8����Ӧ��ƽ��ʱ��N2���������Ϊ20%����CO��ת����Ϊ__________��
��0.8����Ӧ��ƽ��ʱ��N2���������Ϊ20%����CO��ת����Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������0.1mol��L-1��������Һ�� H2SO3��HSO3-��SO32-��������ռ���ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��

A. ��ͼ�����ݿɼ���õ���������������Һ��Ka2
B. ��0.1mol��L-1H2SO3��Һ�У����ڣ�c2(H+)=c(H+)��c(HSO3-)+2c(H+)��c(SO32-)+Kw
C. ��pHΪ7����Һ�е�������ϡ������ɵ���ҺpH�仯С����pHΪ4.0����Һ�е�����ͬ��ϡ������ɵ���ҺpH�仯
D. ��pH=2.0��Һ�У�c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A.��״����2.24LSO3����ˮ����0.1mol![]()
B.6.4g��SO2��S2��ɵĻ���ﺬ�е�ԭ��������0.2NA
C.1molп��������ŨH2SO4��ȫ��Ӧ��ת�Ƶĵ�����С��2NA
D.12g���ʯ(C)�к��еĹ��ۼ���ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NAΪ�����ӵ���������ֵ,����˵����ȷ����
A. 56g��������������ȼ�գ�ת�Ƶĵ�����Ϊ2NA
B. lg��������NA����������
C. ��״����,22.4Lˮ����1molˮ����
D. 2mol�������ϡ���ᷴӦ����NA����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com