
����Ŀ���о�̼���������Ԫ�ػ���������ʻ�ת���Խ�����̬�����������й�������Ҫ���塣
(1)��ˮ����̼�Ĵ�����ʽ���ֲ���ͼ��ʾ��
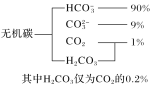
�����ӷ���ʽ��ʾ��ˮ�������Ե�ԭ��______________����֪������ˮpH��8.1��Ԥ���ļ���ˮ���Խ���_____________(���ǿ��������)��
(2)��ҵ����CO��H2Ϊԭ�Ϻϳɼ״��ķ�Ӧ��
CO(g)��2H2(g)![]() CH3OH(g)����H��0�����ݻ�Ϊ1 L�ĺ��������У��ֱ���T1��T2��T3�����¶��ºϳɼ״�����ͼ�����������¶��²�ͬH2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ������˵����ȷ����________(����ĸ)��
CH3OH(g)����H��0�����ݻ�Ϊ1 L�ĺ��������У��ֱ���T1��T2��T3�����¶��ºϳɼ״�����ͼ�����������¶��²�ͬH2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ������˵����ȷ����________(����ĸ)��
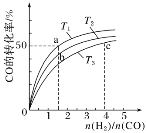
A��a��b��c����H2ת���ʣ�c��a��b
B�����������¶�֮���ϵΪT1��T2��T3
C��a��״̬����ͨ��0.5 mol CO��0.5 mol CH3OH��ƽ�ⲻ�ƶ�
D��c��״̬����ͨ��1 mol CO��4 mol H2����ƽ����H2�������������
(3)NO���ٳ����㱻�ƻ����䷴Ӧ��������ͼ��ʾ��
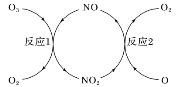
��NO��������___________________��
����֪��
O3(g)��O(g)=2O2(g)����H����143 kJ��mol��1
��Ӧ1��O3(g)��NO(g)=NO2(g)��O2(g)����H1����200.2 kJ��mol��1��
��Ӧ2���Ȼ�ѧ����ʽΪ______________________��
(4)����CO��NO����ͬ����Ͷ��һ�ܱ������з�����Ӧ��2CO(g)��2NO(g)![]() N2(g)��2CO2(g)����H����759.8 kJ��mol��1����Ӧ�ﵽƽ��ʱ��N2�����������
N2(g)��2CO2(g)����H����759.8 kJ��mol��1����Ӧ�ﵽƽ��ʱ��N2�����������![]() �ı仯��������ͼ��
�ı仯��������ͼ��
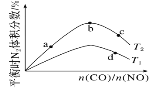
��b��ʱ��ƽ����ϵ��C��Nԭ�Ӹ���֮�Ƚӽ�________��
��a��b��c����CO��ת���ʴӴ�С��˳��Ϊ________��a��c��d�����ƽ�ⳣ���Ӵ�С��˳��Ϊ__________��
����![]() ��0.8����Ӧ��ƽ��ʱ��N2���������Ϊ20%����CO��ת����Ϊ__________��
��0.8����Ӧ��ƽ��ʱ��N2���������Ϊ20%����CO��ת����Ϊ__________��
���𰸡�CO![]() ��H2O
��H2O![]() HCO
HCO![]() ��OH����HCO
��OH����HCO![]() ��H2O
��H2O![]() H2CO3��OH�� ��ǿ C ���� NO2(g)��O(g)=NO(g)��O2(g)����H2����57.2 kJ��mol��1 1��1 a��b��c a��c��d 75%
H2CO3��OH�� ��ǿ C ���� NO2(g)��O(g)=NO(g)��O2(g)����H2����57.2 kJ��mol��1 1��1 a��b��c a��c��d 75%
��������
(1)CO![]() ��H2O
��H2O![]() HCO
HCO![]() ��OH����HCO
��OH����HCO![]() ��H2O
��H2O![]() H2CO3��OH����CO
H2CO3��OH����CO![]() ��HCO
��HCO![]() ˮ��ʹ��Һ�ʼ��ԣ�ˮ�ⷴӦΪ���ȷ�Ӧ�������¶����ߣ�ƽ�������ƶ���c(OH��)���������ļ���ˮ���Խ�����ǿ��
ˮ��ʹ��Һ�ʼ��ԣ�ˮ�ⷴӦΪ���ȷ�Ӧ�������¶����ߣ�ƽ�������ƶ���c(OH��)���������ļ���ˮ���Խ�����ǿ��
(2)A.��ͼ��֪a��b�������H2��CO�����ʵ���֮����ͬ�����COת���ʴ�ģ�H2��ת����Ҳ����Ȼa��b��c���൱������H2�ĺ�������ת���ʱ�С����a��b��c����A����
B.�÷�ӦΪ���ȷ�Ӧ����![]() ��ͬʱ�������¶ȣ���(H2)��С����T3��T2��T1����B����
��ͬʱ�������¶ȣ���(H2)��С����T3��T2��T1����B����
C.a��H2��CO����ʼ��Ϊ1.5:1��COƽ��ת����Ϊ50%���ﵽƽ��ʱCO(g)��H2(g)��CH3OH�����ʵ����ֱ�ΪΪ0.5mol��0.5mol��0.5mol��K=4����ͨ��0.5 mol CO��0.5 mol CH3OH��Q=4��K=Q����ƽ�ⲻ�ƶ�����C��ȷ��
D.c��ͨ��1 mol CO��4 mol H2���൱������ѹǿ��ƽ�������ƶ���H2�����������С����D����
ѡC��
(3)�ٿ�ʼ��NO�μӷ�Ӧ��ѭ����������NO������Ϊ������
��O3(g)��O(g)=2O2
��Ӧ1��O3(g)��NO(g)=NO2(g)��O2(g)����H1����200.2 kJ��mol��1 ��
���ݸ�˹���ɢ�-��÷�Ӧ2���Ȼ�ѧ����ʽNO2(g)��O(g)=NO(g)��O2(g)����H2����57.2 kJ��mol��1��
(4)�ٵ���Ӧ�ﰴ��ѧ������֮�ȼ���ʱ��ƽ��ʱN2������������b��ʱƽ����ϵ��C��Nԭ�Ӹ���֮�Ƚӽ�1��1��
������![]() ��CO��ת���ʽ��ͣ�����CO��ת����a��b��c��ƽ�ⳣ��ֻ���¶��йأ�����a����c���ƽ�ⳣ��K��ͬ���÷�ӦΪ���ȷ�Ӧ������ƽ�������ƶ���N2�����������С������T1��T2��d���ƽ�ⳣ��С��a���c�㣻
��CO��ת���ʽ��ͣ�����CO��ת����a��b��c��ƽ�ⳣ��ֻ���¶��йأ�����a����c���ƽ�ⳣ��K��ͬ���÷�ӦΪ���ȷ�Ӧ������ƽ�������ƶ���N2�����������С������T1��T2��d���ƽ�ⳣ��С��a���c�㣻
����CO��ʼ���ʵ���Ϊ0.8 mol����Ӧ��ƽ��ʱ��COת����x mol�����У�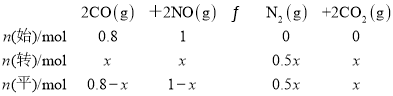
ƽ��ʱ��N2���������Ϊ![]() �����x��0.6������CO��ת����Ϊ
�����x��0.6������CO��ת����Ϊ![]() 75%��
75%��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش�����������
��1����������ȣ�������Ϊȼ�ϵ��ŵ���______________�����ٴ������������������ֱ��ȼ�յ�������ת����Զ����ȼ�ϵ�أ�д����������ȼ�ϵ�صĸ�����Ӧʽ��_____________________________��
��2�������������Ʊ�H2O2����֪��H2(g)+A(l)![]() B(l)��H1 O2(g)+B(l)
B(l)��H1 O2(g)+B(l)![]() A(l)+H2O2(l) ��H2������A��BΪ�л������Ӧ��Ϊ�Է���Ӧ����H2(g)+ O2(g)
A(l)+H2O2(l) ��H2������A��BΪ�л������Ӧ��Ϊ�Է���Ӧ����H2(g)+ O2(g)![]() H2O2(l)�Ħ�H____0(�>������<����=��)��
H2O2(l)�Ħ�H____0(�>������<����=��)��
��3���ں��º��ݵ��ܱ������У�ij���ⷴӦ��MHx(s)+yH2(g)=MHx+2y(s) ��H<0�ﵽ��ѧƽ�⡣�����й�������ȷ����________��
a.����������ѹǿ���ֲ��� b.����y mol H2ֻ��1 mol MHx
c.�����£��÷�Ӧ��ƽ�ⳣ������ d.����������ͨ��������������v(����)>v(����)
��4������̫����ֱ�ӷֽ�ˮ���⣬�����������������;����������ת����ʽΪ_______��
��5�����������ĸ�����Ҳ����������Դ����ⷨ��ȡ�й㷺��;��Na2FeO4��ͬʱ���������Fe+2H2O+2OH![]() FeO42+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
FeO42+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��

�ٵ��һ��ʱ���c(OH-)���͵�������_______��������ҡ��������ҡ�����
�ڵ������У��뽫�������������弰ʱ�ų�����ԭ����________________��
��c(Na2FeO4)���ʼc(NaOH)�ı仯��ͼ2����ѡM��N�����е�һ�㣬����c(Na2FeO4)�������ֵ��ԭ��_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к�H����SO42����NO3-�������ӣ�����H����SO42�������ʵ���Ũ�ȷֱ�Ϊ7.0 mol��L��1��2.0 mol��L��1��ȡ����Һ20 mL������3.2 gͭ�ۣ�����ʹ���dz�ַ�Ӧ�������������ڱ�״���µ����ԼΪ( )
A. 0.75 LB. 0.336 LC. 1.5 LD. 0.448 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ��Targretin(F)�����������Ƥ��T��ϸ���ܰ�������ϳ�·����ͼ��ʾ��

��֪��
i. 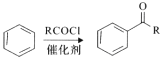
ii. ![]()
![]()
iii.RCOOH![]() RCOCl(R��ʾ������)
RCOCl(R��ʾ������)
(1)��Ӧ�ٵķ�Ӧ������_______________��
(2)B�Ľṹ��ʽ___________��
(3) ![]() ������_____________��
������_____________��
(4)C�ĺ˴Ź�����������ʾ������֮��Ϊ_________________��
(5)��Ӧ�۵Ļ�ѧ����ʽ__________��
(6)F�ķ���ʽ��C24H28O2��F�к��еĹ���������____________��
(7)д��������������A������ͬ���칹��Ľṹ��ʽ(��������O��O����![]() �ṹ)__________��____________��
�ṹ)__________��____________��
a.�����ϵ�һ�ȴ���������
b.���ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
(8)��֪�� ![]() (R��R���ʾ������)����2-�������Ҷ���Ϊԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�
(R��R���ʾ������)����2-�������Ҷ���Ϊԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�![]() ��д���ϳ�·��________��
��д���ϳ�·��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ɴ�����Ⱦ����Ҫ���ʡ��о���������ķ�Ӧ������������������Ⱦ����Ҫ���塣NO�ڿ����д������·�Ӧ��2NO(g)+ O2(g)![]() 2NO2(g) ��H������Ӧ��������ɣ���ͼ1��ʾ��
2NO2(g) ��H������Ӧ��������ɣ���ͼ1��ʾ��
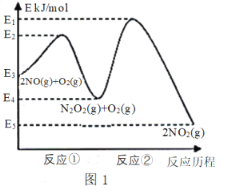
�ش��������⣺
(1)д����Ӧ�ٵ��Ȼ�ѧ����ʽ(��H�ú�������E�ĵ�ʽ��ʾ)��___________��
(2)��Ӧ�ٺͷ�Ӧ���У�һ���ǿ췴Ӧ������ٽ���ƽ��״̬������һ��������Ӧ������2NO(g)+O2(g)![]() 2NO2(g)��Ӧ���ʵ���_______(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������_________(��Ӧδʹ�ô���)��
2NO2(g)��Ӧ���ʵ���_______(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������_________(��Ӧδʹ�ô���)��
(3)T1�¶�ʱ���ݻ�Ϊ2L�ĺ����ܱ�������ֻ����1.00molNO2���巢����Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)�����
2NO2(g)��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
�ٴ�0��2s�÷�Ӧ��ƽ������v(NO2)=___________mol/(L��s)��
��T1�¶�ʱ��ѧƽ�ⳣ��K=___________mol��1��L��
�ۻ�ѧƽ�ⳣ��K�����ʳ���k����k������ѧ��ϵ��K=___________�������������¶ȸı�ΪT2ʱ��k��=k������T1__________T2 (����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ��H
2Fe(s)+3CO2(g) ��H
��Ӧ1�� Fe2O3(s)+3C(ʯī��s) ![]() 2Fe(s)+3CO(g) ��H1
2Fe(s)+3CO(g) ��H1
��Ӧ2�� C(ʯī��s)+CO2(g)![]() 2CO(g) ��H2
2CO(g) ��H2
�١�H= _________(�ú���H1�� ��H2����ʽ��ʾ��
�ڱ����¶Ȳ��䣬�ں��������н��з�Ӧ1���ﵽƽ��״̬���ٴγ���һ������CO (Fe����������ƽ��_________�ƶ�(������������ﵽ��ƽ���c(CO)��_________(��������С�����䡱)
(2)��T��ʱ����Ӧ Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64,��2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64,��2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
Fe2O3 | CO | Fe | CO2 | |
��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�ټ�������CO��ƽ��ת����Ϊ_________
������˵����ȷ����_________������ĸ����
A��������ѹǿ�㶨��˵����Ӧ�ﵽƽ��״̬
B������Fe2O3���������CO��ת����
C����������CO��ƽ��ת���ʴ����ҵ�ƽ��ת����
D���������й����������ٸı䣬˵����Ӧ�ﵽƽ��״̬
��ȡ��ȷ�CO���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У���װ������Fe2O3������Ӧ��ͬʱ��ֱ�ⶨ��ϵ��CO�����������CO%�������������淴Ӧ�¶ȣ�T���仯�Ĺ�ϵͼ�����ڴ��������ƽ��ʱ��������ƽ����Է��������淴Ӧ�¶ȣ�T���ı仯ʾ��ͼ��
_________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(Li3N)���л��ϳɵĴ�����Li3N��ˮ���ҷ�Ӧ��ijС�����ʵ���Ʊ�����﮲��ⶨ�䴿�ȣ�װ����ͼ��ʾ��
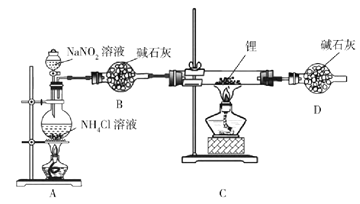
ʵ������NH4Cl��Һ��NaNO2��Һ�����Ʊ�N2��
��1��ʢװNH4Cl��Һ������������___________��
��2����ȫ©���С���ȫ��������__________��ʵ���ҽ�ﮱ�����_____���ú�͡���ʯ���͡���ˮ�����С�
��3��д���Ʊ�N2�Ļ�ѧ����ʽ__________��
��4��Dװ�õ�������____________��
��5���ⶨLi3N��Ʒ���ȣ�ȡmg Li3N��Ʒ����ͼ��ʾװ��ʵ�顣
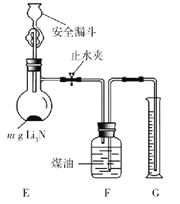
��ֹˮ�У���ȫ©���м�������ˮ����Li3N��ȫ��Ӧ��ƽF��G��Һ�棬���NH3���ΪVL�����ۺϳɱ�״������
�ٶ���ǰ��ƽF��G��Һ���Ŀ����ʹ�ռ�NH3�Ĵ���ѹ________������ڡ���С�ڡ����ڡ���������ѹ��
�ڸ�Li3N��Ʒ�Ĵ���Ϊ________%��ֻ�г���m��V�ļ���ʽ�����ؼ��㻯���� Li3N��Ʒ����Li�����ô���_____________��ѡ�ƫ�ߡ���ƫ�͡�����Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ(C3H6)����Ҫ���л�����ԭ�ϡ�����ֱ�������Ʊ�ϩ�����ķ�Ӧ�У�
��Ӧ����C3H8(g)C3H6(g)+H2(g) ��H1
��Ӧ����2C3H8(g)3C2H4(g)+2H2(g) ��H2
��֪������Ӧ�����Ea(��)С�ڷ�Ӧ�����Ea(��)��
��3�����ʵ�ȼ�������±���
C3H8(g) | C3H6(g) | H2(g) |
��2217.8kJ��mol-1 | ��2058kJ��mol-1 | ��285.8kJ��mol-1 |
��1����H1=_______kJ��mol-1
��2�����º��������£����ܱ������г���1molC3H8(g)�����������˵�����������Ʊ�ϩ��Ӧ�ﵽƽ��״̬����______________��
A���÷�Ӧ��H���ֲ���B����������ƽ��Ħ���������ֲ���
C��![]() ���ֲ���D��C3H8�ֽ�������C3H6�����������
���ֲ���D��C3H8�ֽ�������C3H6�����������
��3��һ���¶��£�������ܱ������г��������ʵ���Ϊ4mol�ı��������������壨�����������ǻ����������Ӧ��ͬʱ�䣬��ϩ������������Ĺ�ϵ��ͼ1��ʾ��ͼ���������ߵ�ԭ����______________��
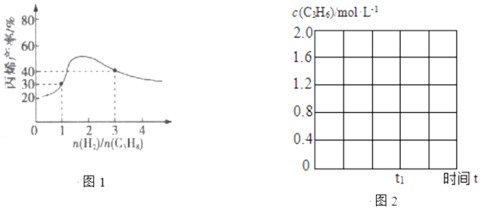
��4������Ӧ�¶�600������10molC3H8(g)����2L�ĸ��������У�����ƽ��ת�������ϩ��ѡ���Ծ�Ϊ40%����Ӧ����ƽ�ⳣ��K=______________��������2λС��������ϩ��ѡ����=![]() ��100%��
��100%��
��600�����������ⷴӦ��t1ʱ��ƽ�⣬����ͼ2�л�����������c(C3H6)��ʱ��t�ı仯ͼ��______________
��5����һ�ȱ���(C3H7Cl)�ķ�ˮ��ͨ���������������ƣ���Ƴ������س�ȥ����ԭ����ͼ3��ʾ��д��N�缫�ĵ缫��Ӧʽ______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾ��װ�ü�ҩƷ��������ǿ���Ƚϵ�ʵ�飬����˵������ȷ����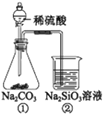
A���������з����ķ�Ӧ��Ϊ���ֽⷴӦ
B����Na2SiO3������Һ�еη�̪��Һ����������
C��һ��ʱ��������н���״��������
D����ʵ����֤������ǿ����˳���ǣ����̼�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com