
【题目】下列说法正确的是( )
A. 铅蓄电池放电时负极质量减轻,充电时阳极质量增加
B. 同温下,0.1 mol·L-1醋酸溶液pH=a,0.01 mol·L-1醋酸溶液pH=b,则a+1<b
C. 钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护
D. 一定条件下反应N2+3H2![]() 2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
【答案】C
【解析】A.铅蓄电池是用填满海绵状铅的铅板作负极,填满二氧化铅的铅板作正极,放电时负极反应为: Pb+SO42--2e-= PbSO4由于PbSO4会附着在负极,故负极的质量增大,故A错误;B.醋酸溶液中,C(CH3COOH)>C(H+),且浓度越小,弱电解质的电离程度越大,0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,如果两种醋酸的电离程度相等,则a+1=b,实际上,0.01mol/L的醋酸电离程度大于0.1mol/L醋酸,所以a+1>b,故B错误;C.用牺牲阳极或外加电流的阴极保护法,铁分别为正极和阴极,都发生还原反应,可防止被氧化,故C正确;D.一定条件下反应N2+3H22NH3的速率关系符合系数比,即v正(H2):v正(NH3)=3:2,当反应达到平衡时,v正(NH3)=v逆(NH3),所以达到平衡时,应为2v正(H2)=3v逆(NH3),故D错误.答案选C.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】(1)我国首艘国产航母于2017年4月顺利下水。制造航母需使用大量特种钢材、复合材料及光纤等。

①HSLA-100是一种航母甲板用钢,不属于这种钢材性质的是_________________(填字母)。
a.强度大 b.耐高温 c.密度小
②航母拦阻索最初由剑麻纤维和钢丝编织而成,现以尼龙和钢丝编织为主,下一代采用材质将是碳纤维。下列属于天然高分子材料的是__________________(填字母)。
a.剑麻纤维 b.尼龙 c.碳纤维
③航母信息系统上大量使用光导纤维,光导纤维的成分是________(填字母)。
a.3CaO·SiO2 b.SiO2 c.聚异戊二烯
(2)压缩鱼粉是由鱼粉、淀粉、水、山梨酸钾等配料加工而成,鱼粉中含有丰富的蛋白质、维生素及矿物元素钙、锌、硒、磷等。
①配料中,属于防腐剂的是___________________(填名称);钙、锌、硒、磷四种元素中属于微量元素的是___________________(填元素名称)。
②鱼粉蛋白质水解能生成多种氨基酸,写出甘氨酸的结构简式:___________________。
③配料中淀粉在人体中完全水解的化学方程式为_____________________。
(3)化学科学与污染防治及绿色发展密切相关。
①用清洁能源替代传统的化石能源是预防酸雨的有效途径之一。通常人们所说的酸雨,其主要有害成分是_____________________(填两种强酸的化学式);积极推广可降解塑料,减少使用聚乙烯等塑料,可防治的环境污染称为_____________________。
②纳米铁可修复被C2HCl3、NO![]() 污染的地下水。C2HCl3在纳米铁作用下,Cl被H取代最终转化为一种气态烃,该气态烃的结构简式为_____________________;NO3-在酸性条件下被纳米铁还原为N2(Fe被氧化为Fe2+)的离子方程式为_____________________。
污染的地下水。C2HCl3在纳米铁作用下,Cl被H取代最终转化为一种气态烃,该气态烃的结构简式为_____________________;NO3-在酸性条件下被纳米铁还原为N2(Fe被氧化为Fe2+)的离子方程式为_____________________。
③绿色合成是从源头上防治污染的前沿学科。水杨酸与(CH3CO)2O在绿色催化剂明矾催化下可生成阿司匹林和乙酸,该反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
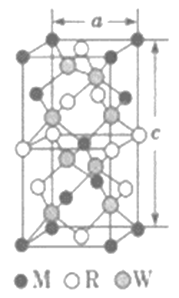
【答案】 Li2O O [Ar]3d9或1s22s22p63s23p63d9 高 O2-半径比S2-半径小,Cu2O比Cu2S的晶格能大,所以Cu2O的熔点高 直线形 sp杂化 [N=N=N]- 4 ![]()
【解析】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素;X的单质为固体,常用作电极材料,X只能为Li元素;Z 是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s22s22p4,为O元素;W是主族元素,与Zspan>原子的价电子数相同 ,W为S元素;R 的价层电子排布式为3d64s2,R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素。
(1)锂与氧气反应生成氧化锂,故答案为:Li2O;
(2)同一主族,从上到下,第一电离能逐渐减小,O和S元素相比,第一电离能较大的是O,Cu2+的核外电子排布式为[Ar]3d9,故答案为:O;[Ar]3d9;
(3)氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高,故答案为:高;氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高;
(4)CO2中的C采用sp杂化,VSEPR 模型为直线型;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-,故答案为:直线型; sp;[N=N=N]-;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;8个S均在体内,由化学式为CuFeS2,则含晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=![]() =
=![]() gcm-3,故答案为:4;
gcm-3,故答案为:4;![]() 。
。
点睛:本题考查晶胞计算及杂化等,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握物质结构与性质、晶胞结构及计算等为解答该题的关键。本题的难点是晶胞的计算。
【题型】推断题
【结束】
12
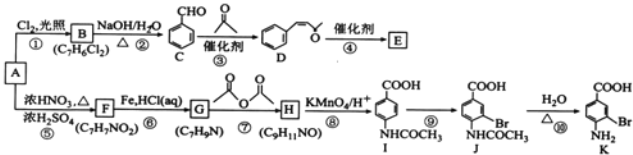
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如图所示:
已知: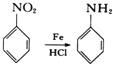 ;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
回答下列问题:
(1)A的名称是_____________。K含有官能团的名称是__________________。
(2)反应⑦的作用是____________________________,⑩的反应类型是____________________________。
(3)写出反应②的化学方程式:____________________________________________________________。
(4)D分子中最多有_____________个原子共平面。E的结构简式为_____________。
(5)1molD与1molH2的加成产物同时满足下列条件的同分异构体有_____________种。
①苯环上只有四种不同化学环境的氢原子;
②能与FeCl3发生显色反应;
③分子中只存在一个环不含其它环状结构。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 _________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO
_________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L的HCl和0.1mol/L的NaOH溶液等体积混合后,溶液pH( )
A. pH<7 B. pH> 7 C. pH=7 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号内为实验室某浓盐酸试剂瓶标签上的有关数据,试根据有关数据回答下列问题:
(盐酸 分子式:HCl 相对分子量:36.5 密度:1.2 g/mL HCl质量分数:36.5%)
(1)该浓盐酸中HCl的物质的量浓度为______________。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是________(填字母)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.4 mol·L-1的稀盐酸。可供选用的仪器有:胶头滴管、玻璃棒、烧杯、药匙、量筒、托盘天平。
①配制稀盐酸时,还缺少的仪器有______________(写仪器名称);该仪器上标有以下五项中的______ (填字母)。
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②该学生需要量取__________mL上述浓盐酸进行配制。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面。(____)
b.量筒量取浓盐酸后又用蒸馏水洗涤2~3次,并将洗液移入容量瓶中。(____)
(4)①假设该同学成功配制了0.4 mol·L-1的盐酸,他又用该盐酸中和含0.4 g氢氧化钠的溶液,则该同学需取__________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g 氢氧化钠的氢氧化钠溶液,发现比①中所求体积偏小,则可能的原因是____________________________(填字母)。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )
A.Cu和稀硝酸反应
B.Zn和稀盐酸反应
C.Fe和稀硫酸反应
D.Al和稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为甲醇燃料电池。下列说法不正确的是

A. C 处通入气体为氧气,在正极参与反应
B. b 处加入的物质为甲醇,发生氧化反应
C. 正极反应式为:O2+4e-+4H+ =2H2O
D. 外电路通过3mol 电子,生成 11.2LCO2 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 原电池中的负极失电子,发生还原反应
B. 原电池中发生氧化反应的电极是负极
C. 原电池中的电极一定要由两种不同的金属组成
D. 原电池中较活泼的金属做正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是

A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com