
【题目】某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )
A.Cu和稀硝酸反应
B.Zn和稀盐酸反应
C.Fe和稀硫酸反应
D.Al和稀盐酸反应
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。B的焰色反应呈黄色,C、D、E、G是常见的气体, C 、D、E是单质且C呈黄绿色;H与G的组成元素相同,H的摩尔质量为32g·mol-1,I是常见的盐类,J是紫红色金属单质。
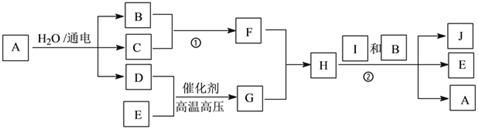
(1)D的化学式为_____________________。
(2)G的电子式为_____________________。
(3)写出反应①的离子方程式:_____________________。
(4)写出反应②的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
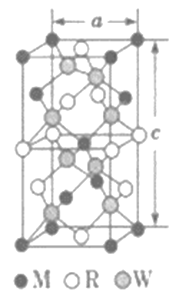
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向0.01 mol·L-1 的醋酸溶液中滴入pH=7 的醋酸铵溶液,溶液pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是

A. a 点,pH = 2
B. b 点,c(CH3COO-) > c(NH4+)
C. c 点,pH 可能大于 7
D. ac 段,溶液pH 增大是CH3COOH 受醋酸铵的影响而不再电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铅蓄电池放电时负极质量减轻,充电时阳极质量增加
B. 同温下,0.1 mol·L-1醋酸溶液pH=a,0.01 mol·L-1醋酸溶液pH=b,则a+1<b
C. 钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护
D. 一定条件下反应N2+3H2![]() 2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了能观察到丁达尔效应,一中鼹鼠科学社的同学在实验室制备Fe(OH)3胶体。
(1)胶体与其他分散系的本质区别是:__。
(2)制备时,将_逐滴滴加至_中,待液体呈_后,停止加热;反应方程式为__。
(3)有一种橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,这叫__现象,证明Sb2S3胶粒带__电荷。
(4)如何设计实验验证制得的氢氧化铁是胶体:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
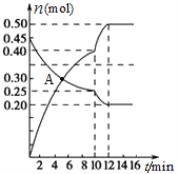
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以C8H10、C3H6为原料生产有机玻璃 PMMA 的单体,同时还可以得到高分子材料 PET 聚酚树脂的单体。 合成路线如下(部分反应条件及产物略去):
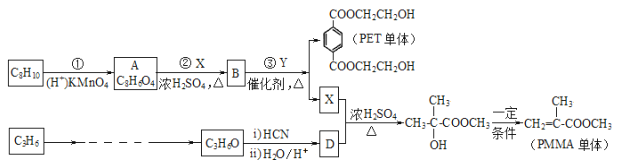
已知: I.RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″均代表烃基)
RCOOR″+R′OH(R、R′、R″均代表烃基)
II.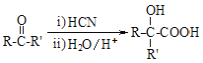
请回答下列问题:
(1)化合物 A 的官能团名称__________, ③的反应类型_____________。
(2)反应②的化学方程式_______________________________。
(3)写出符合下列要求,与 PMMA 单体互为同分异构体的所有同分异构体的结构简式是___________。
①红外光谱(IR)证明分子结构中有碳碳双键;
②1H 核磁共振谱(1H-NMR)显示有四种不同的氢原子。
③能与碳酸氢钠反应产生气体;
(4)Y 的结构简式_________________。
(5)写出 C3H6 到 C3H6O 的合成路线(试剂及溶剂任选;合成路线参照“已知 II”中的书写形式)
_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢气燃料电池如下图所示,a、b均为惰性电极。下列叙述不正确的是
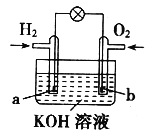
A. 电池总反应方程式为:2H2+O2=2H2O
B. a极是负极,该电极材料不参与电极反应
C. b极反应是:O2+4OH--4e-=2H2O
D. 氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com