
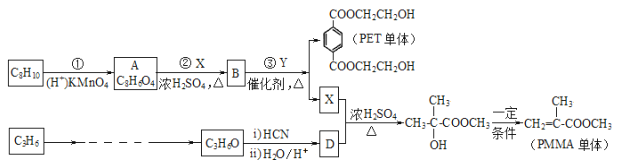
【题目】工业上以C8H10、C3H6为原料生产有机玻璃 PMMA 的单体,同时还可以得到高分子材料 PET 聚酚树脂的单体。 合成路线如下(部分反应条件及产物略去):
已知: I.RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″均代表烃基)
RCOOR″+R′OH(R、R′、R″均代表烃基)
II.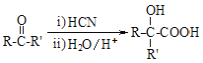
请回答下列问题:
(1)化合物 A 的官能团名称__________, ③的反应类型_____________。
(2)反应②的化学方程式_______________________________。
(3)写出符合下列要求,与 PMMA 单体互为同分异构体的所有同分异构体的结构简式是___________。
①红外光谱(IR)证明分子结构中有碳碳双键;
②1H 核磁共振谱(1H-NMR)显示有四种不同的氢原子。
③能与碳酸氢钠反应产生气体;
(4)Y 的结构简式_________________。
(5)写出 C3H6 到 C3H6O 的合成路线(试剂及溶剂任选;合成路线参照“已知 II”中的书写形式)
_______________________。
【答案】 羧基 取代反应 ![]() +2CH3OH
+2CH3OH ![]()
 +2H2O
+2H2O ![]() ;
;![]() HOCH2CH2OH CH2=CHCH3
HOCH2CH2OH CH2=CHCH3![]()
![]()
![]()
![]()
【解析】由D、X反应产物可知,则D、X分别为CH2=C(CH3)COOH、CH3OH中的一种,C3H6转化为C3H6O,而C3H6O与发生信息中反应得到D,可知D为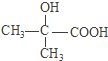 ,C3H6O为
,C3H6O为![]() ,C3H6为CH2=CHCH3,丙烯与水发生加成反应生成
,C3H6为CH2=CHCH3,丙烯与水发生加成反应生成![]() ,然后发生催化氧化得到
,然后发生催化氧化得到![]() .C8H10发生氧化反应生成A,A与与甲醇发生酯化反应生成B,B与Y发生交换反应得到
.C8H10发生氧化反应生成A,A与与甲醇发生酯化反应生成B,B与Y发生交换反应得到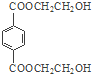 与甲醇,可知B为
与甲醇,可知B为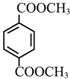 ,Y为HOCH2CH2OH,A为
,Y为HOCH2CH2OH,A为![]() ,C8H10为
,C8H10为![]() 。
。
(1)A为![]() ,化合物A的官能团名称为羧基,③的反应类型为取代反应,故答案为:羧基;取代反应;
,化合物A的官能团名称为羧基,③的反应类型为取代反应,故答案为:羧基;取代反应;
(2)反应②的化学方程式:![]() +2CH3OH
+2CH3OH![]()
 +2H2O,故答案为:
+2H2O,故答案为:![]() +2CH3OH
+2CH3OH![]()
 +2H2O;
+2H2O;
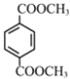
(3)PMMA 的单体为![]() ,①红外光谱(IR)证明分子结构中有碳碳双键;②1H 核磁共振谱(1H-NMR)显示有四种不同的氢原子;③能与碳酸氢钠反应产生气体,说明结构中含有羧基;满足条件的同分异构体有
,①红外光谱(IR)证明分子结构中有碳碳双键;②1H 核磁共振谱(1H-NMR)显示有四种不同的氢原子;③能与碳酸氢钠反应产生气体,说明结构中含有羧基;满足条件的同分异构体有![]() ;
;![]() ,故答案为:
,故答案为:![]() ;
;![]()
(4)由上述分析可知,Y的结构简式为:HOCH2CH2OH,故答案为:HOCH2CH2OH;
(5)C3H6到C3H6O的合成路线:CH2=CHCH3![]()
![]()
![]()
![]() ,故答案为:CH2=CHCH3
,故答案为:CH2=CHCH3![]()
![]()
![]()
![]() 。
。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图所示)。保持400℃条件下发生反应:2SO2+O2![]() 2SO3。则下列描述正确的是( )
2SO3。则下列描述正确的是( )

A. 达到平衡所需要的时间:A容器更短
B. 达到平衡时:B容器中SO3的转化率更大
C. 达到平衡时:A容器中SO2的物质的量更多
D. 达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )
A.Cu和稀硝酸反应
B.Zn和稀盐酸反应
C.Fe和稀硫酸反应
D.Al和稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①2Fe2++Br2![]() 2Fe3++2Br-,②2Br-+Cl2
2Fe3++2Br-,②2Br-+Cl2![]() Br2+2Cl-,③2Fe3++2I-
Br2+2Cl-,③2Fe3++2I-![]() 2Fe2++I2。
2Fe2++I2。
由此判断下列说法错误的是
A. 氧化性强弱顺序为:Cl2>Br2>Fe3+>I2
B. 反应②中当有1 mol Cl2被还原时,有2mol Br-被氧化
C. 铁元素在反应①和③中均被氧化
D. 还原性强弱顺序为:I->Fe2+>Br->Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 原电池中的负极失电子,发生还原反应
B. 原电池中发生氧化反应的电极是负极
C. 原电池中的电极一定要由两种不同的金属组成
D. 原电池中较活泼的金属做正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
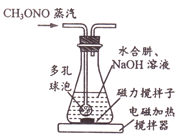
(1)制备NaN3:
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是

A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害。若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是( )
A.Fe2+、Cu2+
B.Cu2+ 、 H+
C.Zn2+ 、Fe2+
D.Zn2+ 、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com