
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
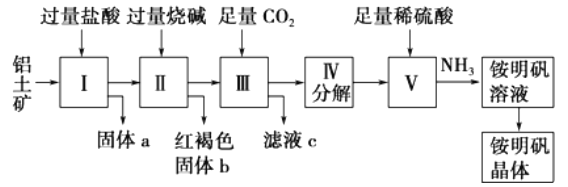
请回答下列问题:
(1)固体a的化学式为____,固体b化学式为____,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________.
(2)由Ⅴ制取铵明矾溶液的化学方程式为______________.
(3)由I→II→III→IV都要用到的分离方法是______,由铵明矾溶液中制铵明矾晶体的操作是______________.
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__.
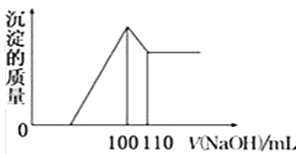
(5)向10gFe2O3、SiO2和Al2O3的混合物中,加入100ml稀硫酸,过滤后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示.则混合物中三氧化二铝的质量分数为______.
【答案】 SiO2 Fe(OH)3 AlO2﹣+CO2+2H2O═HCO3﹣+Al(OH)3↓ Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O 过滤 蒸发浓缩、冷却结晶、过滤洗涤 Fe2O3 51%
【解析】(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2,固体b化学式为: Fe(OH)3 ;Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3 沉淀,故答案为:SiO2; AlO2-+CO2+2H2O═HCO3-+Al(OH)3 ↓;(2)由Ⅴ制取铵明矾溶液的化学方程式为Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O ;(3)由I→II→III→IV都要用到的分离方法是过滤,由铵明矾溶液中制铵明矾晶体的操作是蒸发浓缩、冷却结晶、过滤洗涤;(4)如果先向铝土矿加入过量氢氧化钠,Fe2O3与过量氢氧化钠不反应,此时首先出现的固体a是Fe2O3; (5)加入盐酸体积100mL~110mL时,发生的反应是Al(OH)3+OH―=AlO2―+2H2O,可知n(Al(OH)3 )=n(NaOH)=0.01L×10mol/L=0.1mol,则n(Al2O3)=0.05mol,m(Al2O3)=0.05mol×102g/mol=5.1g,则混合物中三氧化二铝的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,不正确的是
A. 钠燃烧时发出黄色的火焰 B. 钠燃烧时生成氧化钠
C. 钠有很强的还原性 D. 钠原子的最外层只有一个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为:Zn + 2H2O + 2MnO2==Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
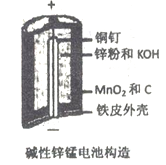
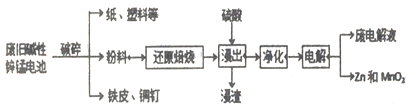
回答下列问题:
(1)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),碳作为还原剂生成CO2,则CO2的电子式为___________。
(2)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。己知浸出液中Mn2+、Zn2+的浓度约为0.1mol·L-1,根据下列数据计算,调节pH的合理范围是____至_______。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(离子浓度小于1×10-5 mol·L-1即为沉淀完全)
(3)“电解”时,阳极的电极反应式为______________。
本工艺中应循环利用的物质是____________(填化学式)。
(4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为___________________。
(5)某碱性锌锰电池维持电流强度0.5A (相当于毎秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015上海卷】实验室回收废水中苯酚的过程如右图所示。下列分析错误的是( )
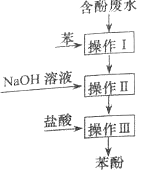
A.操作I中苯作萃取剂
B.苯酚钠在苯中的溶解度比在水中的大
C.通过操作II苯可循环使用
D.三步操作均需要分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计计如下图所示装罝(部分夹持装置己略去)进行实验探究:
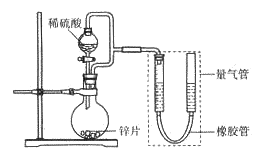
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是_______________。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________(填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________(填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【陕西省西安市长安区第一中学大学区2017届高三第三次联考理综】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
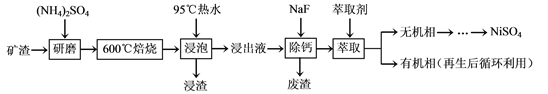
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是__________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,
加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;
除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为________________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
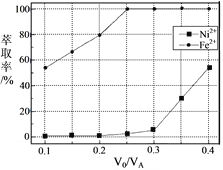
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【安徽省黄山市2017届高三第二次模拟考试理科综合】
硫酸锌用于制造立德粉,并用作媒染剂、收敛剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·7H2O, 工艺流程如图l:
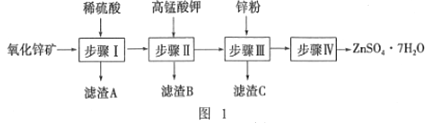
(l)步骤I的操作是_____,滤渣A的主要成分是_____。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是______。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为_____________。
(4)步骤Ⅲ得到的滤液中,阳离子是___________。(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是_______。
(6)取28.70 gZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。650℃时所得固体的化学式为_______(填字母序号)。

a. ZnO b. Zn3O(SO4)2 c. ZnSO4 d. ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 碳酸钡可用于医疗上检查肠胃的内服剂 B. SiO2 是一种重要的半导体材料
C. 热的纯碱溶液可以去除物品表面的油污 D. MgO 可被大量用于制造火箭和飞机的部件
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com