
【题目】碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为:Zn + 2H2O + 2MnO2==Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
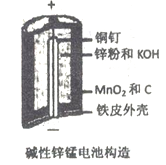
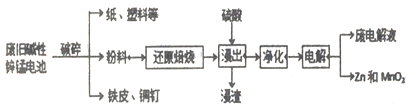
回答下列问题:
(1)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),碳作为还原剂生成CO2,则CO2的电子式为___________。
(2)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。己知浸出液中Mn2+、Zn2+的浓度约为0.1mol·L-1,根据下列数据计算,调节pH的合理范围是____至_______。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(离子浓度小于1×10-5 mol·L-1即为沉淀完全)
(3)“电解”时,阳极的电极反应式为______________。
本工艺中应循环利用的物质是____________(填化学式)。
(4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为___________________。
(5)某碱性锌锰电池维持电流强度0.5A (相当于毎秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
【答案】 ![]() H2O2 (或KMnO4) 3 6 Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 2MnOOH+6HCl
H2O2 (或KMnO4) 3 6 Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 2MnOOH+6HCl![]() Cl2↑+2MnCl2↑+4H2O 87
Cl2↑+2MnCl2↑+4H2O 87
【解析】(1)CO2是共价化合物,其CO2的电子式为![]() ;
;
(2) “净化”是为了除去浸出液中的Fe2+,利用H2O2溶液具有氧化性将Fe2+氧化为Fe3+,再由Mn(OH)2、Zn(OH)2的KSP近似值可求得Mn2+,Zn2+开始沉淀时的氢氧根浓度分别为![]() =10-6,
=10-6, ![]() =10-8,即Mn2+,Zn2+开始沉淀时的pH分别为8和6,而Fe(OH)3沉淀完全时的氢氧根浓度为
=10-8,即Mn2+,Zn2+开始沉淀时的pH分别为8和6,而Fe(OH)3沉淀完全时的氢氧根浓度为![]() =10-11,即Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀;
=10-11,即Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀;
(3)电解阳极Mn2+失电子发生氧化反应生成MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,阴极Zn2+得电子发生还原反应生成Zn,废电解液为硫酸,则本工艺中应循环利用的物质是H2SO4 ;
(4)“粉料”中的MnOOH具有氧化性,与盐酸发生氧化还原反应,则反应的化学方程式为2MnOOH+6HCl![]() 2MnCl2+4H2O+Cl2↑;
2MnCl2+4H2O+Cl2↑;
(5)80分钟转移电子的物质的量为5×10-6 mol×80×60=0.024mol,则消耗的Zn的质量为![]() ×65g/mol=0.78g,所以如果制造一节电池所需的锌粉为6g,则电池失效时仍有
×65g/mol=0.78g,所以如果制造一节电池所需的锌粉为6g,则电池失效时仍有![]() ×100%=87%的金属锌未参加反应。
×100%=87%的金属锌未参加反应。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势,
如图所示:
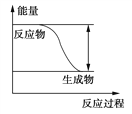
(1)该反应为________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______极(填“正”或“负”); 铜电极上发生的电极反应为__________________。
Ⅱ、某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
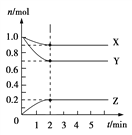
(4)反应开始至2 min,Y的平均反应速率________。
(5)分析有关数据,写出X、Y、Z的反应方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是
A. 稀硫酸 B. CuSO4溶液 C. Fe2(SO4)3溶液 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【河北省邢台市第二中学2017届高三上学期第三次月考】下述实验不能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 将 | 制备 |
B | 向沸水中滴加几滴 | 制备 |
C | 向某溶液中加入稀 | 检验溶液中是否含有 |
D | 相同温度下,测定浓度分别为0.1mol·L-1的 | 比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是( )

A. 电负性:c>b>a B. 最简单氢化物的稳定性:c>a>b
C. I5:a>c>b D. 最简单氢化物的沸点:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
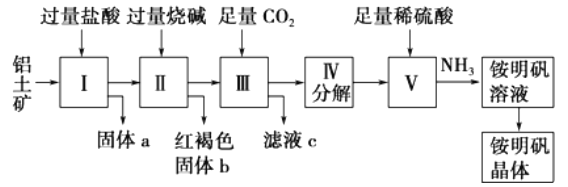
请回答下列问题:
(1)固体a的化学式为____,固体b化学式为____,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________.
(2)由Ⅴ制取铵明矾溶液的化学方程式为______________.
(3)由I→II→III→IV都要用到的分离方法是______,由铵明矾溶液中制铵明矾晶体的操作是______________.
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__.
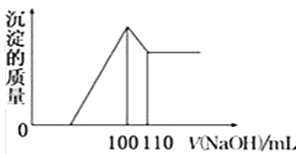
(5)向10gFe2O3、SiO2和Al2O3的混合物中,加入100ml稀硫酸,过滤后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示.则混合物中三氧化二铝的质量分数为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为2 mol、B为5 mol,5 min末时达到化学平衡状态,此时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
3C(g)+nD(g),开始时A为2 mol、B为5 mol,5 min末时达到化学平衡状态,此时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
(1)5 min末A的物质的量浓度为______________。
(2)前5 min内用B表示的化学反应速率v(B)为______________。
(3)化学方程式中n值为______________。
(4)平衡时B的转化率为______________。
(5)反应开始时与达到平衡后容器中压强之比为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com