
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为2 mol、B为5 mol,5 min末时达到化学平衡状态,此时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
3C(g)+nD(g),开始时A为2 mol、B为5 mol,5 min末时达到化学平衡状态,此时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
(1)5 min末A的物质的量浓度为______________。
(2)前5 min内用B表示的化学反应速率v(B)为______________。
(3)化学方程式中n值为______________。
(4)平衡时B的转化率为______________。
(5)反应开始时与达到平衡后容器中压强之比为______________。
【答案】 0.5 mol/L 0.2 mol·L-1·min-1 2 40% 7∶9
【解析】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为2 mol、B为5 mol,
3C(g)+nD(g),开始时A为2 mol、B为5 mol,
5 min末时达到化学平衡状态,此时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1,生成D是0.2 mol·L-1·min-1×2L×5min=2mol,变化量之比是相应的化学计量数之比,则n=2,则
A(g)+2B(g)![]() 3C(g)+2D(g)
3C(g)+2D(g)
起始量(mol) 2 5 0 0
转化量(mol) 1 2 3 2
平衡量(mol) 1 3 3 2
(1)5 min末A的物质的量浓度为1mol÷2L=0.5mol/L。
(2)反应速率之比是相应的化学计量数之比,因此前5 min内用B表示的化学反应速率v(B)为0.2 mol·L-1·min-1。
(3)化学方程式中n值为2。
(4)平衡时B的转化率为2/5×100%=40%。
(5)压强之比是相应的化学计量数之比,因此反应开始时与达到平衡后容器中压强之比为7:9。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为:Zn + 2H2O + 2MnO2==Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
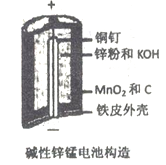
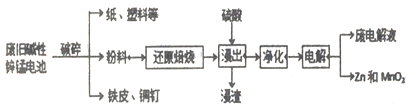
回答下列问题:
(1)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),碳作为还原剂生成CO2,则CO2的电子式为___________。
(2)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。己知浸出液中Mn2+、Zn2+的浓度约为0.1mol·L-1,根据下列数据计算,调节pH的合理范围是____至_______。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(离子浓度小于1×10-5 mol·L-1即为沉淀完全)
(3)“电解”时,阳极的电极反应式为______________。
本工艺中应循环利用的物质是____________(填化学式)。
(4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为___________________。
(5)某碱性锌锰电池维持电流强度0.5A (相当于毎秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【陕西省西安市长安区第一中学大学区2017届高三第三次联考理综】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
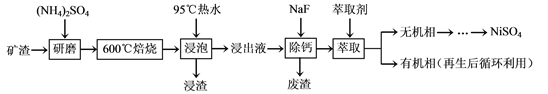
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是__________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,
加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;
除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为________________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
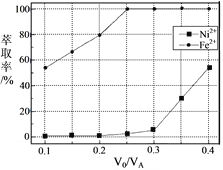
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【安徽省黄山市2017届高三第二次模拟考试理科综合】
硫酸锌用于制造立德粉,并用作媒染剂、收敛剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·7H2O, 工艺流程如图l:
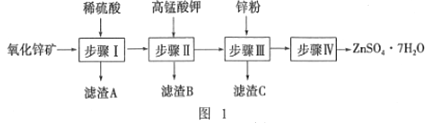
(l)步骤I的操作是_____,滤渣A的主要成分是_____。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是______。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为_____________。
(4)步骤Ⅲ得到的滤液中,阳离子是___________。(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是_______。
(6)取28.70 gZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。650℃时所得固体的化学式为_______(填字母序号)。

a. ZnO b. Zn3O(SO4)2 c. ZnSO4 d. ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. CS2为V形的极性分子 B. ClO3—的空间构型为平面三角形
C. SiF4和SO32—的中心原子均为sp2杂化 D. SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 碳酸钡可用于医疗上检查肠胃的内服剂 B. SiO2 是一种重要的半导体材料
C. 热的纯碱溶液可以去除物品表面的油污 D. MgO 可被大量用于制造火箭和飞机的部件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]铃兰醛具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰、东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如下图所示:

(1)B中官能团的名称是 ;
(2)④的反应类型是 ;
(3)写出反应②的化学方程式 ;
(4)乌洛托品的结构式如图所示,其二氯取代物有 种;

将甲醛的水溶液与氨水混合蒸发可制得乌洛托品,该反应的化学方程式 ;
(5)写出满足下列条件的A的同分异构体
Ⅰ.有两个取代基; Ⅱ.取代基在邻位。
(6)已知:![]() 。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸
。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸 的合成路线流程图(无机试剂可以任选):
的合成路线流程图(无机试剂可以任选):
CH3CH2CHO→ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com