
【题目】【陕西省西安市长安区第一中学大学区2017届高三第三次联考理综】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
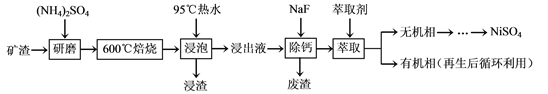
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是__________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,
加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;
除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为________________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
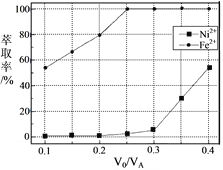
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
【答案】增大接触面积,加快反应速率,使反应更充分
Fe3++2H2O![]() FeO(OH)↓+3H+ SiO2、CaSO4 0.5
FeO(OH)↓+3H+ SiO2、CaSO4 0.5
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 2.0×10-3 0.25
【解析】(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是增大接触面积,加快反应速率,使反应更充分;(2))“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为 Fe3++2H2O![]() FeO(OH)↓+3H+,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4;(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(4)浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3molL-1=1×10-5mol/L,溶液中c2(F-) =Ksp/c(Ca2+)=4.0×1011/1×105,所以c2(F-) =2×10-3mol/L;(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25。
FeO(OH)↓+3H+,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4;(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(4)浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3molL-1=1×10-5mol/L,溶液中c2(F-) =Ksp/c(Ca2+)=4.0×1011/1×105,所以c2(F-) =2×10-3mol/L;(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25。


科目:高中化学 来源: 题型:
【题目】右图三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是( )

A. 电负性:c>b>a B. 最简单氢化物的稳定性:c>a>b
C. I5:a>c>b D. 最简单氢化物的沸点:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
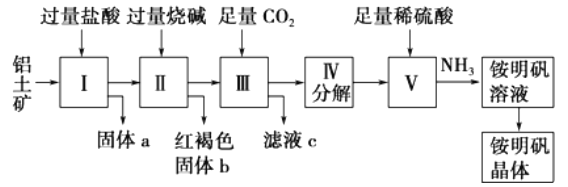
请回答下列问题:
(1)固体a的化学式为____,固体b化学式为____,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________.
(2)由Ⅴ制取铵明矾溶液的化学方程式为______________.
(3)由I→II→III→IV都要用到的分离方法是______,由铵明矾溶液中制铵明矾晶体的操作是______________.
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__.
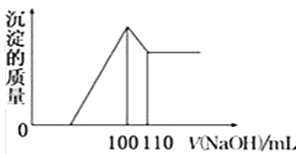
(5)向10gFe2O3、SiO2和Al2O3的混合物中,加入100ml稀硫酸,过滤后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示.则混合物中三氧化二铝的质量分数为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届河北衡水中学全国高三大联考(全国卷)理科综合化学试】
下列操作和现象所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2(g) | 增大压强,平衡逆向移动 |
B | 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 | 原溶液中一定含有Fe3+ |
C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
D | 25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大 | 酸性:H2C2O4<HF |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”对化学反应提出了“原子经济性”(原子利用率100%)的概念及要求。以下反应中符合“绿色化学”的是
A. 乙烯与氧气在银的催化作用下生成环氧乙烷(![]() )
)
B. 利用乙烷与氯气反应,制备氯乙烷
C. 以苯、浓硝酸和浓硫酸为原料,制备硝基苯
D. Cu与浓硫酸反应制备CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为2 mol、B为5 mol,5 min末时达到化学平衡状态,此时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
3C(g)+nD(g),开始时A为2 mol、B为5 mol,5 min末时达到化学平衡状态,此时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
(1)5 min末A的物质的量浓度为______________。
(2)前5 min内用B表示的化学反应速率v(B)为______________。
(3)化学方程式中n值为______________。
(4)平衡时B的转化率为______________。
(5)反应开始时与达到平衡后容器中压强之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体结构的描述正确的是( )
A.冰中存在极性键、非极性键、范德华力、氢键
B.金属钾的晶胞空间利用率小于金属钋的晶胞空间利用率
C.36g金刚石晶体和36g石墨晶体含有的C—C数目相同
D.干冰的晶胞中CO2数目和金属铜的晶胞中Cu原子数目相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com