
| A、pH=2的盐酸溶液中含有的阳离子数为0.02NA |
| B、100g 98%的浓硫酸中含氧原子个数为4NA |
| C、标准状况下,22.4LCHCl3所含有的分子数目为NA |
| D、25℃时,pH=12的1.0L NaClO溶液中由水电离出的OH-的数目为0.01NA |


科目:高中化学 来源: 题型:
| A、480 mL |
| B、600 mL |
| C、800 mL |
| D、960 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g过氧化钠晶体中,含2NA个阴离子 |
| B、足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子 |
| C、200mL5mol?L-1Na2CO3溶液中,含NA个CO32- |
| D、3mol铁与足量的水蒸气充分反应,转移电子8NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
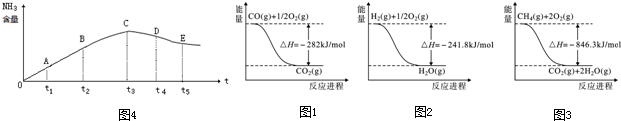

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.1mol/L CO32-溶液中:Al3+、NH4+、NO3-、HCO3- |
| B、常温下,pH=12的溶液中:AlO2-、ClO-、SO32-、Na+ |
| C、使甲基橙变红的溶液中:Cr2O72-、Fe2+、SO42-、K+ |
| D、加入过量氨水溶液仍然澄清的溶液中:Cu2+、Ag+、NO3-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8g18O2中含有NA个电子 |
| B、1L 0.1mol/L硅酸钠溶液中含有0.1NA个SiO32- |
| C、标准状况下,11.2LCO2和NO2混合气体中含NA氧原子 |
| D、0.1mol 铁粉与足量的盐酸充分反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同浓度、同体积的强酸与强碱溶液混合后,溶液一定为中性 |
| B、在Na2S溶液中:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)] |
| C、含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO3-) |
| D、在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.
如图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com