
【题目】利用碳纳米管能够吸附氢气,设计一种新型二次电池,其装置如图所示。关于该电池的叙述不正确的是( )
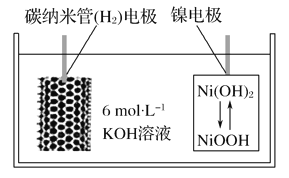
A. 电池放电时K+移向正极
B. 电池放电时负极反应为:H2-2e-+2OH-===2H2O
C. 电池充电时镍电极上NiOOH转化为Ni(OH)2
D. 电池充电时碳纳米管电极与电源的负极相连
科目:高中化学 来源: 题型:
【题目】关于原子结构的叙述正确的是
A.所有的原子核都是由质子和中子组成的B.原子的最外层电子数不超过8个
C.稀有气体原子的最外层电子数均为8D.原子的次外层电子数都是2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”实验已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠的反应实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A. ②③④
B. ①②③
C. ①②④
D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温常压下,1mol SO2的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示。已知电池放电时的反应为4Li+FeS2==Fe+2Li2S。下列说法正确的是( )
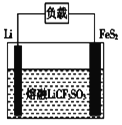
A. Li为电池的正极
B. 电池工作时,Li+向负极移动
C. 正极的电极反应式为FeS2+4e-=Fe+2S2-
D. 将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )

A. 逸出气体的体积:a电极的小于b电极的
B. a电极附近呈蓝色,b电极附近呈红色
C. a电极附近呈红色,b电极附近呈蓝色
D. 一电极逸出无味气体,另一电极逸出刺激性气味气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生社团根据老师的指导进行实验研究:一块下衬白纸的玻璃片上有a、b、c、d四个位置,分别滴加浓度为0.1 mol/L的四种溶液各1滴,每种彼此分开,形成一个个小液滴。在圆心e处放置2粒芝麻粒大小的KMnO4晶体,然后向KMnO4晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。
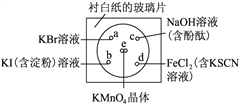
完成下列填空:
(1)e处立即发生反应,化学方程式如下,请配平,并标出电子转移方向和数目______。
![]() KMnO4+
KMnO4+![]() HCl(浓)→
HCl(浓)→![]() KCl+
KCl+![]() MnCl2+
MnCl2+![]() Cl2↑+
Cl2↑+![]() H2O
H2O
(2)在元素周期表中Cl、Br、I位于___________________ 族 ,它们最高价氧化物所对应水化物酸性最强的是__________________(填化学式)。
(3)b处实验现象为_____________________。d处反应的离子方程式为__________________,通过此实验________(填“能”或“不能”)比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是___________________________________。
(4)常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是__________。
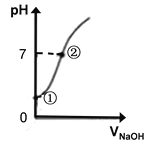
A.①处所示溶液中存在的电离平衡不止一个
B.由①到②的过程中,溶液由酸性逐渐变为碱性
C.由①到②的过程中,水的电离程度逐渐减弱
D.②处所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
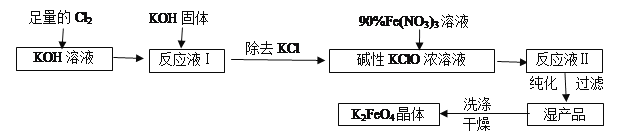
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式___________。
(2)在溶液Ⅰ中加入KOH固体的目的是________(填编号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为________。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为________mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体)+ O2↑+ OH-。___________
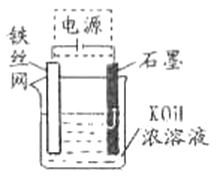
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com