
����Ŀ��ijѧ�����Ÿ�����ʦ��ָ������ʵ���о���һ���³İ�ֽ�IJ���Ƭ����a��b��c��d�ĸ�λ�ã��ֱ�μ�Ũ��Ϊ0.1 mol/L��������Һ��1�Σ�ÿ�ֱ˴˷ֿ����γ�һ����СҺ�Ρ���Բ��e������2��֥������С��KMnO4���壬Ȼ����KMnO4����μ�һ��Ũ���ᣬ����������Ǻá��ɹ۲쵽a��b��c��d��e���λ�þ������Է�Ӧ��
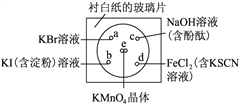
���������գ�
��1��e������������Ӧ����ѧ����ʽ���£�����ƽ�����������ת�Ʒ������Ŀ______��
![]() KMnO4��
KMnO4��![]() HCl(Ũ)��
HCl(Ũ)��![]() KCl��
KCl��![]() MnCl2��
MnCl2��![]() Cl2����
Cl2����![]() H2O
H2O
��2����Ԫ�����ڱ���Cl��Br��Iλ��___________________ �� �������������������Ӧˮ����������ǿ����__________________���ѧʽ����
��3��b��ʵ������Ϊ_____________________��d����Ӧ�����ӷ���ʽΪ__________________��ͨ����ʵ��________����ܡ����ܡ����Ƚ�Cl2��FeCl3��KMnO4�������������Ե�ǿ�������ܣ�������������ǿ������˳����___________________________________��
��4�������£�����ˮ����ε���0.1mol/L������������Һ��pH�仯����ͼ��ʾ�������й�������ȷ����__________��
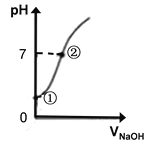
A���ٴ���ʾ��Һ�д��ڵĵ���ƽ�ⲻֹһ��
B���ɢٵ��ڵĹ����У���Һ��������Ϊ����
C���ɢٵ��ڵĹ����У�ˮ�ĵ���̶�����
D���ڴ���ʾ��Һ�У�c(Na+)��c(Cl��) + c(ClO��)
���𰸡� 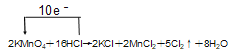 ��A�� HClO4 ����ɫ��Ϊ��ɫ Cl2��2Fe2+��2 Cl���� 2Fe3+ �� KMnO4>Cl2>FeCl3 A��D
��A�� HClO4 ����ɫ��Ϊ��ɫ Cl2��2Fe2+��2 Cl���� 2Fe3+ �� KMnO4>Cl2>FeCl3 A��D
����������1��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�۵õ�5�����ӣ�ClԪ�ػ��ϼ۴ӣ�1�����ߵ�0�ۣ�ʧȥ1�����ӣ����ݵ��ӵ�ʧ�غ��֪��ƽ��ķ���ʽ�Լ�����ת�Ʒ������Ŀ�ɱ�ʾΪ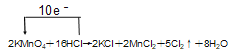 ����2����Ԫ�����ڱ���Cl��Br��Iλ�ڵڢ�A�壬ͬ������ϵ��·ǽ������������ǽ�����Խǿ����ۺ����������Խǿ���������������������Ӧˮ����������ǿ����HClO4����3��b���������û����⣬2KI+Cl2��2KCl+I2���������۱���ɫ����b��ʵ������Ϊ��Һ����ɫ����ɫ��d�����������Ȼ���������Ӧ�����ӷ���ʽΪCl2��2Fe2+��2Cl����2Fe3+��������ԭ��Ӧ����������������ǿ����������������ԣ���Ӧ2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O��������KMnO4��Cl2����Ӧ2FeCl2+Cl2=2FeCl3��������Cl2��FeCl3�����������Դ�С˳����KMnO4��Cl2��FeCl3����4��A���ٴ���ʾ��Һ����ˮ�����д��ڵĵ���ƽ�ⲻֹһ������ˮ��������ĵ���ƽ���������ˮ��Ӧ�Ļ�ѧƽ�⣬A��ȷ��B���ɢٵ��ڵĹ����У���Һ����������������Ϊ���ԣ�B����C���ɢٵ��ڵĹ�����������Ũ����С��������������ˮ�����Ƴ̶�������ˮ�ĵ���̶�������C����D���ڴ���ʾ��Һ�����ԣ����ݵ���غ��֪��Һ��c(Na+)��c(Cl��)+c(ClO��)��D��ȷ����ѡAD��
����2����Ԫ�����ڱ���Cl��Br��Iλ�ڵڢ�A�壬ͬ������ϵ��·ǽ������������ǽ�����Խǿ����ۺ����������Խǿ���������������������Ӧˮ����������ǿ����HClO4����3��b���������û����⣬2KI+Cl2��2KCl+I2���������۱���ɫ����b��ʵ������Ϊ��Һ����ɫ����ɫ��d�����������Ȼ���������Ӧ�����ӷ���ʽΪCl2��2Fe2+��2Cl����2Fe3+��������ԭ��Ӧ����������������ǿ����������������ԣ���Ӧ2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O��������KMnO4��Cl2����Ӧ2FeCl2+Cl2=2FeCl3��������Cl2��FeCl3�����������Դ�С˳����KMnO4��Cl2��FeCl3����4��A���ٴ���ʾ��Һ����ˮ�����д��ڵĵ���ƽ�ⲻֹһ������ˮ��������ĵ���ƽ���������ˮ��Ӧ�Ļ�ѧƽ�⣬A��ȷ��B���ɢٵ��ڵĹ����У���Һ����������������Ϊ���ԣ�B����C���ɢٵ��ڵĹ�����������Ũ����С��������������ˮ�����Ƴ̶�������ˮ�ĵ���̶�������C����D���ڴ���ʾ��Һ�����ԣ����ݵ���غ��֪��Һ��c(Na+)��c(Cl��)+c(ClO��)��D��ȷ����ѡAD��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A(g)+B(g)![]() 2C(g)����Ӧ���̻������C%���¶ȹ�ϵ����ͼ������˵����ȷ����
2C(g)����Ӧ���̻������C%���¶ȹ�ϵ����ͼ������˵����ȷ����
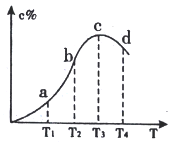
A. ����Ӧ����: v(c)>v(d)>v(b) B. ��ѧƽ�ⳣ��: K(d)>K(c)
C. ��c��d�仯ʱ,v(��)<v(��) D. �ÿ��淴Ӧ������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼�����ܹ��������������һ�����Ͷ��ε�أ���װ����ͼ��ʾ�����ڸõ�ص���������ȷ����( )
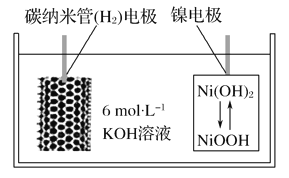
A. ��طŵ�ʱK����������
B. ��طŵ�ʱ������ӦΪ��H2��2e����2OH��===2H2O
C. ��س��ʱ���缫��NiOOHת��ΪNi(OH)2
D. ��س��ʱ̼���ܵ缫���Դ�ĸ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����У���ͬһ������� ( )
A.Mg��Be��CaB.O��As��SC.N��P��SeD.F��I��Ar
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�з��ϰ�ȫҪ����ǣ� ��
A.����ú��ʱ���û������
B.�����ڼ䣬�ڿ����Ĺ㳡ȼ���̻�����
C.�õ�ȼ�Ļ����Һ������ƿ�ڼ����Ƿ�©��
D.ʵ��ʱ����ˮ����Ũ��������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
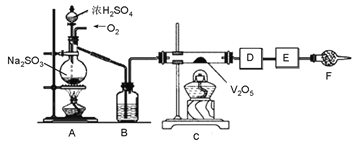
����Ŀ����ͼ��ʵ��װ�ÿ������о�SO2ת��ΪSO3��ת���ʡ���֪��SO3���۵���16.8�棬�е���44.8�档A��ΪSO2���巢��װ�ã�C��ΪSO2��O2��Ӧ��װ�á�
���������գ�
��1��A���Ļ�ѧ��Ӧ����ʽΪ_______________������F������Ϊ_____��
��2������ʵ����Ҫ��Ӧ����D��E�����Ӻ��ʵ�װ�á������ͼ��ѡ����ѡװ�õ����������Ӧ�Ŀո�D��__________��E:_________��

��3����amolNa2SO3��ĩ������Ũ������д�ʵ�飬��A����Ӧ����ʱ���ټ���ͨ��һ��ʱ��O2�������E��װ������bg�����ʱSO2��ת����Ϊ__________%���ú�a��b�Ĵ���ʽ��ʾ����
��4����Na2SO3���ʣ���Ӱ�쵽SO2��ת������������ijNa2SO3��Ʒ�Ƿ���ʣ���ķ�����____________��
��5��ʵ�������������ռ���SO3��װ�ó���¶���ڿ����У��ɿ���װ�ó��ڴ�����������������ԭ����________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ���������ռ������漰���¼�����Ҫ�Σ�
![]()
![]()
![]()
![]() �����
�����
(1)д��ʵ������ȡ���������ӷ���ʽ____________________________��NA��ʾ�����ӵ�������ֵ������4 mol��HCl����������ת�Ƶĵ�������Ϊ______����������MnO2Ͷ�뺬2 mol HCl��Ũ�����У���ּ��ȣ������ɵ�Cl2________(����������������������)0.5 mol��
(2)����3���Լ��ɹ�ѡ��A.����ʳ��ˮ��B��Ũ���ᡡC��NaOH��Һ����Y��ҺӦѡ��________(����ĸ)��X��Һ��������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ļ��Գɷ֣����ڿ�ǻ�в������ոУ��ܹ���Ѫѹ�͵��̴��Ĺ�Ч�������ںܴ�̶���Ԥ�����ಡ��Ҳ�ܻ��⼡��ؽ���ʹ���������������Ľṹ���Ա�ʾΪ��
 ��R������
��R������
����һ���������������J�ĺϳ�·�����£�
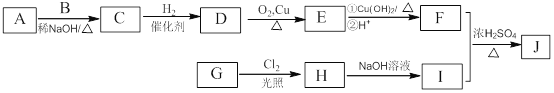
��֪��
��A��B��EΪͬϵ�����B����Է�������Ϊ44��A��B�˴Ź���������ʾ��������壻
��������J�ķ���ʽΪC15H22O4��
��
�ش��������⣺
��1��G���������ŵ�����Ϊ ��
��2����A��B����C�Ļ�ѧ����ʽΪ ��
��3����C����D�ķ�Ӧ����Ϊ ��D�Ļ�ѧ����Ϊ ��
��4����H����I�Ļ�ѧ����ʽΪ ��
��5��J�Ľṹ��ʽΪ ��
��6��G��ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�ֵĹ��� �֣����������칹�����˴Ź���������ʾ2������ ��д�ṹ��ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��SO2��SO3�ķ��Ӹ���֮��Ϊ1��1ʱ��ԭ������֮��Ϊ________������֮��Ϊ________��
(2)�кͺ�0.2 mol HCl��ϡ���ᣬ��NaOH������Ϊ________g��
(3)��5 mol��L��1��Mg(NO3)2��Һa mLϡ����b mL��ϡ�ͺ���Һ��NO![]() �����ʵ���Ũ����______ mol��L��1��
�����ʵ���Ũ����______ mol��L��1��
(4)�õ������0.1 mol��L��1��BaCl2��Һ����ʹ��ͬ�����Fe2(SO4)3��Na2SO4��KAl(SO4)2������Һ�е�SO![]() ��ǡ����ȫ�����������������ε����ʵ���Ũ��֮��Ϊ________��
��ǡ����ȫ�����������������ε����ʵ���Ũ��֮��Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com