
����Ŀ��ʵ������ȡ���������ռ������漰���¼�����Ҫ�Σ�
![]()
![]()
![]()
![]() �����
�����
(1)д��ʵ������ȡ���������ӷ���ʽ____________________________��NA��ʾ�����ӵ�������ֵ������4 mol��HCl����������ת�Ƶĵ�������Ϊ______����������MnO2Ͷ�뺬2 mol HCl��Ũ�����У���ּ��ȣ������ɵ�Cl2________(����������������������)0.5 mol��
(2)����3���Լ��ɹ�ѡ��A.����ʳ��ˮ��B��Ũ���ᡡC��NaOH��Һ����Y��ҺӦѡ��________(����ĸ)��X��Һ��������____________________��
���𰸡�MnO2��4H����2Cl��![]() Mn2����2H2O��Cl2����4NA��B��ȥCl2�е�HCl
Mn2����2H2O��Cl2����4NA��B��ȥCl2�е�HCl
��������
(1)ʵ�����ö���������Ũ�����ڼ��������·�Ӧ������������Ӧ�����ӷ���ʽΪMnO2��4H����2Cl��![]() Mn2����2H2O��Cl2�����ɷ���ʽ��֪������4 mol�Ȼ���μӷ�Ӧ������2 mol�Ȼ��ⱻ������ת�Ƶ��ӵ����ʵ���Ϊ2 mol������4 mol HCl��������ת�Ƶĵ�������Ϊ4NA����������MnO2Ͷ�뺬2 mol HCl��Ũ�����У����ŷ�Ӧ�Ľ��У�Ũ�������ϡ����Ӧ��ֹͣ������2 mol HCl����ȫ�����뷴Ӧ���ɷ���ʽ��֪����4 mol HCl�μӷ�Ӧ��������Cl2�����ʵ���Ϊ1 mol����������MnO2Ͷ�뺬2 mol HCl��Ũ�����У���ּ��ȣ�������Cl2����С��0.5 mol��
Mn2����2H2O��Cl2�����ɷ���ʽ��֪������4 mol�Ȼ���μӷ�Ӧ������2 mol�Ȼ��ⱻ������ת�Ƶ��ӵ����ʵ���Ϊ2 mol������4 mol HCl��������ת�Ƶĵ�������Ϊ4NA����������MnO2Ͷ�뺬2 mol HCl��Ũ�����У����ŷ�Ӧ�Ľ��У�Ũ�������ϡ����Ӧ��ֹͣ������2 mol HCl����ȫ�����뷴Ӧ���ɷ���ʽ��֪����4 mol HCl�μӷ�Ӧ��������Cl2�����ʵ���Ϊ1 mol����������MnO2Ͷ�뺬2 mol HCl��Ũ�����У���ּ��ȣ�������Cl2����С��0.5 mol��
(2) ����Ũ������лӷ��ԣ�������ȡ�������л�����Ȼ����ˮ�����������ռ�����֮ǰҪ��ȥ�Ȼ����ˮ��������Ӧ�ȳ�ȥ�Ȼ������壬Ȼ���ȥˮ����������X��ҺΪ����ʳ��ˮ��Y��ҺΪŨ���ᡣ


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ��ѧ��ʵ�����߽����ã�����������������ɫ��ѧ������

��ʵ�����ռ���������ͼ����ʾװ��
��ʵ���������������Ƶķ�Ӧʵ��ʱ����ͼ����ʾװ��
��ʵ�������ò������ֱ�պȡŨ�����Ũ��ˮ����������������ε�ʵ��
��ʵ�����в���ͼ����ʾװ�ý���ͭ��ϡ����ķ�Ӧ
A. �ڢۢ�
B. �٢ڢ�
C. �٢ڢ�
D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�϶�������������ԭ��Ӧ���ǣ� ��
A.���Ϸ�Ӧ
B.�ֽⷴӦ
C.�û���Ӧ
D.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ�����Ÿ�����ʦ��ָ������ʵ���о���һ���³İ�ֽ�IJ���Ƭ����a��b��c��d�ĸ�λ�ã��ֱ�μ�Ũ��Ϊ0.1 mol/L��������Һ��1�Σ�ÿ�ֱ˴˷ֿ����γ�һ����СҺ�Ρ���Բ��e������2��֥������С��KMnO4���壬Ȼ����KMnO4����μ�һ��Ũ���ᣬ����������Ǻá��ɹ۲쵽a��b��c��d��e���λ�þ������Է�Ӧ��
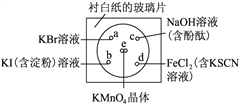
���������գ�
��1��e������������Ӧ����ѧ����ʽ���£�����ƽ�����������ת�Ʒ������Ŀ______��
![]() KMnO4��
KMnO4��![]() HCl(Ũ)��
HCl(Ũ)��![]() KCl��
KCl��![]() MnCl2��
MnCl2��![]() Cl2����
Cl2����![]() H2O
H2O
��2����Ԫ�����ڱ���Cl��Br��Iλ��___________________ �� �������������������Ӧˮ����������ǿ����__________________���ѧʽ����
��3��b��ʵ������Ϊ_____________________��d����Ӧ�����ӷ���ʽΪ__________________��ͨ����ʵ��________����ܡ����ܡ����Ƚ�Cl2��FeCl3��KMnO4�������������Ե�ǿ�������ܣ�������������ǿ������˳����___________________________________��
��4�������£�����ˮ����ε���0.1mol/L������������Һ��pH�仯����ͼ��ʾ�������й�������ȷ����__________��
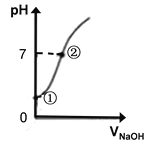
A���ٴ���ʾ��Һ�д��ڵĵ���ƽ�ⲻֹһ��
B���ɢٵ��ڵĹ����У���Һ��������Ϊ����
C���ɢٵ��ڵĹ����У�ˮ�ĵ���̶�����
D���ڴ���ʾ��Һ�У�c(Na+)��c(Cl��) + c(ClO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A. ���Ӿ����е�ÿ��������һ�����й��ۼ�
B. ԭ�Ӿ����е�����ԭ�Ӽ�ֻ���ڷǼ��Թ��ۼ�
C. ���Ӿ����п��ܺ��й��ۼ�
D. ����������۵�ͷе㶼�ܸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ӧ������ͼ��ʾ�ķ����о����ʵ����ʣ���������A����Ҫ�ɷ��������������ǿ�����ˮ�������ش��������⣺
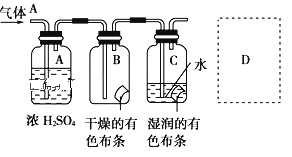
(1)�����о�(ʵ��)����ҪĿ����__________________________________��
(2)ŨH2SO4�������� _______________________�����о�Ŀ��ֱ����ص�ʵ��������___________________��
(3)���������ʵķ���������������ʵ����ƻ����ڲ���֮��������������������Ϊ__________________������D����ͼ����ʽ�����˷������Ĵ�ʩ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ʵ�����к͵ζ�ʵ�����ƣ�����0.1000mol/L�����Ը��������Һ�ζ�δ
֪Ũ�ȵ���ɫ������������Һ���ش��������⣺
��1���ζ�ǰ��ϴ�ζ��ܵIJ�������__________��
��2��ijͬѧ��õ�ʵ���������±�
1 | 2 | 3 | 4 | |
������������Һ���mL | 25.00 | 25.00 | 25.00 | 25.00 |
�ζ��ܳ����mL | 0.00 | 1.02 | 1.00 | 0.80 |
�ζ���ĩ���mL | 40.02 | 41.00 | 41.00 | 42.90 |
�����Һ���������Ƶ����ʵ���Ũ��________��
��3���ζ�ǰƽ�Ӹ������Һ�棬��ζ��յ������Һ�棬�����ֵ��ʵ��ֵ___���ƫ�ߡ���ƫ�͡����䡱�� ��
��4��������0.1000mol/L��������Һ��H2SO3 HSO3- SO32-������ռ���ʵ�������(a)��pH�仯�Ĺ�ϵ��ͼ��ʾ����֪lg2=0.3����ԭ������������Һ��pH=_______��
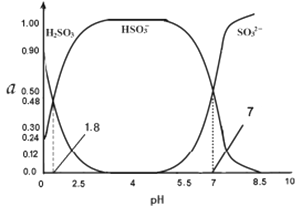
��5��ȡ����������������Һ1L���ȼ����������ƹ��壬ʹ��Һ��pH=10�����ٶ��ӹ������Һ��������䣩�������Һ���ܽ����ᱵ�����ʵ���n=______����֪���¶�ʱKSp��BaSO4��=1.0��10-10 KSp(BaSO3��=1.0��10-8 ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)��һ�ּ�������������������һ������Ͷ��ˮ����������������������������
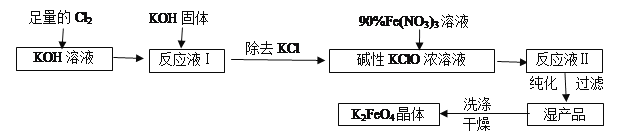
��ش�����������
��1��д����KOH��Һ��ͨ������Cl2������Ӧ�����ӷ���ʽ___________��
��2������Һ���м���KOH�����Ŀ����________(����)��
A��Ϊ��һ����Ӧ�ṩ���ԵĻ���
B��ʹKClO3ת��ΪKClO
C������Һ���й�����Cl2������Ӧ�����ɸ����KClO
D��KOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ����
��3������Һ���з����K2FeO4�����и���ƷKNO3��KCl,��Ӧ���з��������ӷ�Ӧ����ʽΪ________��ÿ�Ƶ�59.4��K2FeO4,���������������������ʵ���Ϊ________mol��
��4���������(K2FeO4)��Ϊˮ��������һ���ŵ�������ˮ��Ӧ���ɽ����������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ�� FeO42-+ H2O= Fe(OH)3(����)+ O2��+ OH-��___________
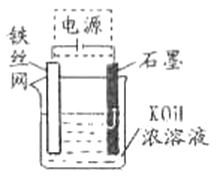
��5���ӻ��������ĽǶȿ����Ʊ�K2FeO4�Ϻõķ���Ϊ��ⷨ����װ����ͼ��ʾ���������������ĵ缫��ӦʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����0.lmol��L-1NaOH��Һ�ֱ�ζ������Ϊ20.00mL��Ũ�Ⱦ�Ϊ0.1mol��L-1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�
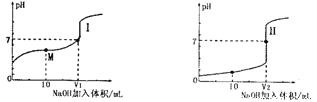
�ٵζ������������__________(�I����)��
��V1��V2�Ĺ�ϵ��V1______V2(�>������=����<��)
��M���Ӧ����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳����_______________��
��2��Ϊ���о������ܽ�ƽ��ͳ���ת����ijͬѧ�������ϲ��������ʵ�顣������AgSCN�ǰ�ɫ����
�������� | ���� |
����1����2mL0.005mol��L-1AgNO3��Һ�� ����2mL0.005mol��L-1KSCN��Һ������ | ���ְ�ɫ���� |
����2��ȡlmL�ϲ���Һ���Թ������μ�1 ��2 mol��L-1Fe(NO3)3��Һ | ��Һ���ɫ |
����3������2����Һ�У���������5��3mol��L-1 AgNO3��Һ | ���ְ�ɫ��������Һ��ɫ��dz |
����4������1���µ���Һ�м���5��3 mol��L-1 KI��Һ | ���ֻ�ɫ���� |
��д������2����Һ���ɫ�����ӷ���ʽ______________________��
���û�ѧƽ��ԭ�����Ͳ���3��ʵ������______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com