
【题目】某课外实验小组设计的下列实验不合理的是 ( )
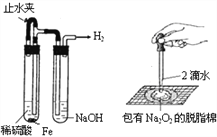
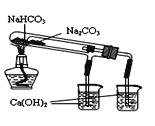
A. 图1:制备并观察氢氧化亚铁 B. 图2:证明过氧化钠与水反应放热
C. 图3:萃取分液时放出碘的苯溶液 D. 图4:比较NaHCO3和Na2CO3热稳定性
科目:高中化学 来源: 题型:
【题目】对于0.1molL﹣1 NH4Cl溶液,正确的是( )
A.升高温度,溶液pH升高
B.通入少量HCl,c(NH4+)和c(Cl﹣)均增大
C.c(NH4+)+c(OH﹣)=c(Cl﹣)+c(H+)
D.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应 SiO2(s)+C(s)+N2(g)![]() Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
A. 该反应的氧化剂为N2,还原产物为CO
B. 增加焦炭的用量,生成氮化硅的反应速率增大
C. 反应中每生成0.1 mol Si3N4转移的电子为1.2 mol
D. 反应的平衡常数可表示为K=c(CO)/c(N2),升高温度K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
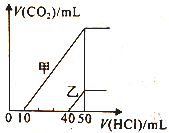
A. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
B. 当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为OH-+H+=H2O
C. 乙溶液中含有的溶质是Na2CO3、NaHCO3
D. 乙溶液中滴加盐酸后产生CO2体积的最大值为224mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?_____(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________,反应的离子方程式为_____________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:___________;
(2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为________________;
(3)熔融物中铝元素的物质的量为_______mol。
(4)B点对应的沉淀的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 向Fe(NO3)2 稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B. 铜片与浓HNO3:Cu+NO3-+4H+=Cu2++NO↑+2H2O
C. 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. SO2通入BaCl2溶液中,SO2+Ba2++H2O=BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某冶炼厂排放的废酸(主要成分为盐酸,含Fe2+. Pb2+. Cu2+. H3AsO3等杂质)和锌渣(含ZnO、Zn及其他酸不溶物)为原料制备电池级ZnCl2溶液的工艺流程如下:
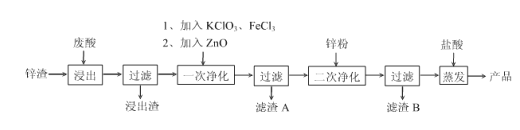
已知:Fe3+开始沉淀时pH为2.7,FeAsO4难溶于水。
回答下列问题
(1)H3AsO3(亚砷酸)中As元素的化合价是________。
(2)“浸出”时反应池应远离火源。原因是________。
(3)“一次净化”可以除去Fe、As元素,加入KClO3、FeCl3除去铁时发生反应的离子方程式为________________________,加入ZnO的目的是________________________,其余反应为KClO3+3H3AsO3 ![]() KCl+3H3AsO4 和FeCl3+H3AsO4
KCl+3H3AsO4 和FeCl3+H3AsO4![]() FeAs04+3HCl,则滤渣A的成分是________,________。
FeAs04+3HCl,则滤渣A的成分是________,________。
(4)“产品”中的主要杂质是________,避免产生该杂质的改进方案是_______________________。
(5)锌聚苯胺电池具有价格便宜、重量轻等优点,在电动汽车行业应用前景广阔。负极使用的是高纯度锌片,以ZnCl2和NH4Cl为主要电解质。锌聚苯胺电池放电时,负极材料上的电极反应式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com