
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?_____(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________,反应的离子方程式为_____________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:___________;
(2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为________________;
(3)熔融物中铝元素的物质的量为_______mol。
(4)B点对应的沉淀的物质的量为____mol。
【答案】 合理 NaOH溶液 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ B 8Fe+30H++3NO3﹣═8 Fe3++3NH4++9 H2O Al(OH)3 + OH- =AlO2- + 2H2O 0.012 0.048
【解析】I.(1)铝热反应的原理为:2Al+Fe2O3![]() Al2O3+2Fe,反应过程中生成铁单质,铝粉可能有剩余,结合题给熔点数据和信息:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金,因此说法是合理的。(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铁与氢氧化钠溶液不反应。证明上述所得的块状熔融物中含有金属铝的实验方案为取少量熔融物于试管中,向其中滴加氢氧化钠溶液,看固体是否部分溶解,是否有气体生成。该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(3)A、常温下,浓硫酸能使铁、铝钝化,A错误;B、铁铝均与稀硫酸反应,生成的氢气对环境无污染,B正确;C、稀硝酸与铁、铝反应时会产生有毒气体NO,C错误;D、氢氧化钠溶液与铁不反应,D错误。答案选B
Al2O3+2Fe,反应过程中生成铁单质,铝粉可能有剩余,结合题给熔点数据和信息:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金,因此说法是合理的。(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铁与氢氧化钠溶液不反应。证明上述所得的块状熔融物中含有金属铝的实验方案为取少量熔融物于试管中,向其中滴加氢氧化钠溶液,看固体是否部分溶解,是否有气体生成。该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(3)A、常温下,浓硫酸能使铁、铝钝化,A错误;B、铁铝均与稀硫酸反应,生成的氢气对环境无污染,B正确;C、稀硝酸与铁、铝反应时会产生有毒气体NO,C错误;D、氢氧化钠溶液与铁不反应,D错误。答案选B
Ⅱ.(1)分析图像知OA段没有沉淀生成,说明硝酸过量,则熔融物中的铁与稀硝酸反应生成硝酸铁,反应过程中无气体生成,则硝酸的还原产物为硝酸铵,利用化合价升降法结合原子守恒、电荷守恒配平,该反应的离子方程式为8Fe+30H++3NO3-=8Fe 3+ +3NH4+ +9H2O;(2)在CD段,沉淀的物质的量减少,生成的氢氧化铝被氢氧化钠溶解,则此阶段发生反应的离子方程式为Al(OH)3+OH- =AlO2-+2H2O;(3)由图可知,CD段消耗的氢氧化钠溶液的体积为44mL-42mL=2mL,故参加反应的氢氧化钠为0.002L×6mol/L=0.012mol,根据Al(OH)3+OH- =AlO2-+2H2O可知,Al(OH)3的物质的量为0.012mol,根据铝元素守恒知熔融物中铝元素的物质的量为0.012mol。(4)AB段发生的反应为Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,消耗氢氧化钠的物质的量为(39-15)×10-3L×6mol/L=0.144mol,Al3+的物质的量为0.012mol,消耗氢氧化钠的物质的量为0.036mol,则与Fe3+反应的氢氧化钠的物质的量为0.144mol-0.036mol=0.108mol,Fe3+的物质的量为0.036mol,B点铝离子和铁离子恰好完全生成沉淀,根据元素守恒知生成沉淀的物质的量为0.048mol。


科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。
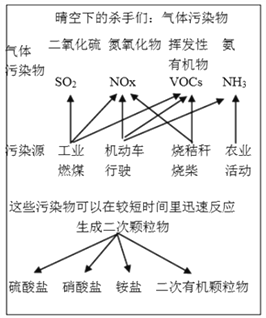
(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_______________。
a.SO2 b.NOx c.VOCs d. NH3
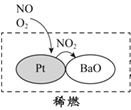
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______________。
(3)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
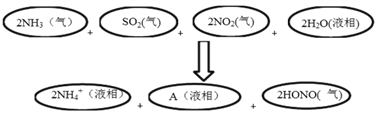
请判断A的化学式并说明判断理由:_____________________________________________。
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42 | NO3 | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.0×104 | 3.4×103 |
①SO2和NaClO2溶液反应的离子方程式是________________________________________。
②表中y =_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 升甲气体和2 升乙气体恰好完全化合生成2 升丙气体(同温同压),若丙气体的分子式为YX2,则甲和乙的分子式依次为
A.X2 与Y2 B.XY 与X2 C. X2 与YX D.YX 与Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组设计的下列实验不合理的是 ( )
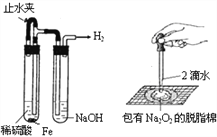
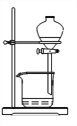
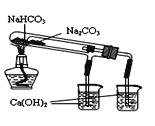
A. 图1:制备并观察氢氧化亚铁 B. 图2:证明过氧化钠与水反应放热
C. 图3:萃取分液时放出碘的苯溶液 D. 图4:比较NaHCO3和Na2CO3热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02被脊为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下22.4 LNO与11.2LO2 充分反应,产物的分子数为NA
B. 0.1mol/L的Na2SO4溶液中,SO42- 数目是0.1NA
C. 标准状况下.22.4L氯气与足量铁粉充分反应,转移的电子数为3NA
D. 0.1molCH4的核外电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。

供选试剂:30%H2O2溶液、0.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向I的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青霉素是一种良效广谱抗生素,经酸性水解后得到青霉素氨基酸分子的结构简式如图.下列关于该物质的叙述不正确的是( ) 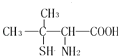
A.属于α﹣氨基酸
B.能发生加聚反应生成多肽
C.核磁共振氢谱上共有5个峰
D.青霉素过敏严重者会导致死亡,用药前一定要进行皮肤敏感试验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,有以下试剂:①蒸馏水②0.01mol/L的盐酸③pH=12的氨水④pH=11的碳酸钠溶液,上述溶液中由水电离的c(H+)关系正确的是( )
A.②>①
B.③>④
C.①>④
D.②=③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com