
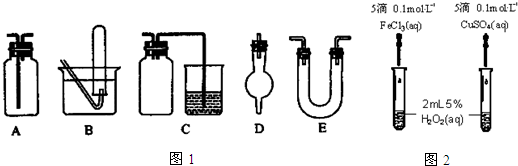
分析 (1)在加热时,为了保证结晶水全部失去,称量操作至少要进行4次;
(2)依据中和热测定需要的仪器回答即可;
(3)①氨气为碱性气体,常用碱性干燥剂碱石灰固体干燥,以此选择所用仪器;
②一氧化氮易与氧气反应,只能用排水法收集;
③除去氯气中氯化氢等杂质气体的装置应为洗气瓶,只有A可以;
④乙烯与溴水反应制二溴乙烷的实验为气体和液体的反应,所用仪器具有双孔橡皮塞;
⑤易溶的气体收集需要防止倒吸;
(4)①比较反应速率的大小可通过生成气体的快慢来判断;
②比较不同催化剂的催化效果,应排除其它因素的干扰.
解答 解:(1)实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止,一般情况下,结晶水含量测定时称量次数不得少于四次,故答案为:4;
(2)中和热的测定实验中需要用的主要玻璃仪器有:二只大小不同的烧杯、二只大小相同的量筒、温度计、环形玻璃搅拌捧,
故答案为:环形玻璃搅拌棒、量筒;
(3)①氨气为碱性气体,常用碱性干燥剂碱石灰固体干燥,而碱石灰只能填装在D、E中,故答案为:D、E;
②氯气既可用向上排空气法收集可用A,也可用排饱和食盐水收集用B,一氧化氮易与氧气反应2NO+O2=2NO2,一氧化氮密度与空气密度相当,所以只能用排水法收集,所以既能用于收集氯气又能用于收集一氧化氮气体的装置只能用B,故答案为:B;
③除去氯气中氯化氢等杂质气体的装置应为洗气瓶,A用作洗气瓶,装有饱和食盐水,长管进短管出,故答案为:A;
④乙烯与溴水反应CH2=CH2+Br2→CH2BrCH2Br,A装置具有双孔橡皮塞,可用作乙烯与溴水反应制二溴乙烷的实验装置,乙烯从长导管进入,瓶中装有溴水,故答案为:A;
⑤二氧化碳易溶于氢氧化钠中,安全瓶的作用是防止倒吸,故答案为:防止倒吸;
(4)①比较反应速率的大小可通过生成气体的快慢来判断,根据2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑可知,以生成的气体O2快慢来判断反应的快慢,故答案为:以生成的气体O2快慢来判断反应的快慢;
②比较不同催化剂的催化效果,应排除其它因素的干扰,氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用;将CuSO4改为CuCl2或将FeCl3改为Fe2(SO4)3阴离子相同,可以消除阴离子不同对实验的干扰,故答案为:由于CuSO4、FeCl3中的阴离子不同,不能排除阴离子的因素;将FeCl3改为Fe2(SO4)3.
点评 本题考查了硫酸铜结晶水的检验、实验室中常见气体的收集与除杂、催化剂的作用及化学反应速率的影响因素等知识点,题目有一定的难度.


科目:高中化学 来源: 题型:选择题
 ,下列关于它的叙述正确的是( )
,下列关于它的叙述正确的是( )| A. | L-多巴只含有2中官能团 | |
| B. | L-多巴不能发生肽反应 | |
| C. | L-多巴既具有酸性,又具有碱性 | |
| D. | 1molL-多巴只能与含1molNaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
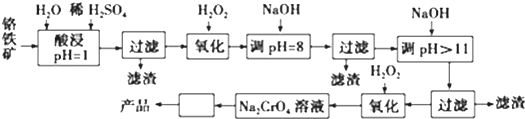
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量氯气反应时转移的电子数为3NA | |
| B. | 1L2mol•L-1 K2S溶液中S2-和HS-的总数为2NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜微热反应,转移的电子数为1.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
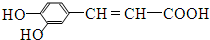 .下列有关咖啡酸的说法中,不正确的是( )
.下列有关咖啡酸的说法中,不正确的是( )| A. | 咖啡酸分子中的所有原子不可能共平面 | |
| B. | 咖啡酸可以发生还原、酯化、加聚、显色等反应 | |
| C. | 1mol咖啡酸可与4 mol Br2发生反应 | |
| D. | 1mol咖啡酸与NaOH溶液反应最多消耗1mol的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
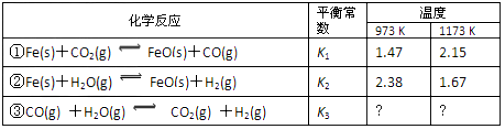

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,(CH3)3COH的名称2-甲基-2-丙醇(系统命名法)
,(CH3)3COH的名称2-甲基-2-丙醇(系统命名法)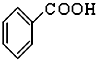 ⑤CH3CHO ⑥
⑤CH3CHO ⑥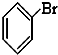
 和
和 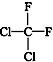 ⑥
⑥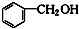 和
和 ⑦CH3CH2NO2和
⑦CH3CH2NO2和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com