
 ,下列关于它的叙述正确的是( )
,下列关于它的叙述正确的是( )| A. | L-多巴只含有2中官能团 | |
| B. | L-多巴不能发生肽反应 | |
| C. | L-多巴既具有酸性,又具有碱性 | |
| D. | 1molL-多巴只能与含1molNaOH的溶液反应 |
分析 该物质中含有酚羟基、苯环、羧基和氨基,具有酚、苯和氨基酸的性质,能发生氧化反应、加成反应、缩聚反应、取代反应等,据此分析解答.
解答 解:A.含有酚羟基、氨基和羧基三种官能团,故A错误;
B.含有羧基和氨基,所以能发生成肽反应,故B错误;
C.含有羧基,所以具有酸性,含有氨基,所以具有碱性,故C正确;
D.酚羟基、羧基都能和氢氧化钠反应,所以1molL-多巴最多能与2molNaOH的溶液反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查酚、氨基酸的性质,注意:含有羧基、羟基或氨基的有机物能发生缩聚反应,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:多选题
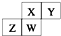 如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | z的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | w的最高价氧化物的水化物可能为弱酸,也有可能为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl | |
| D. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 2:3:6 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都能形成酸雨 | B. | 两者都能与NaOH溶液反应 | ||
| C. | 两者都既有氧化性,又有还原性 | D. | 两者与水反应都生产强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
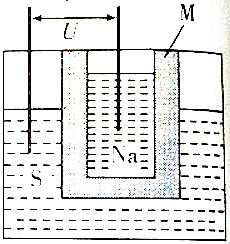
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
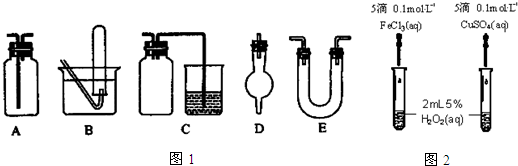
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com