
| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
分析 强酸强碱盐中阴阳离子都不水解,则其水溶液呈中性;强酸弱碱盐,阳离子水解导致溶液呈酸性;强碱弱酸盐,弱酸根离子水解导致溶液呈碱性,酸电离出氢离子导致溶液呈酸性,据此分析解答.
解答 解:A.硫酸钾是强酸强碱盐,钾离子和硫酸根离子都不水解,则其水溶液呈中性,故A错误;
B.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,故B错误;
C.醋酸钠是强碱弱酸盐,醋酸根离子水解导致水溶液呈碱性,故C正确;
D.亚硫酸是酸,电离出氢离子导致水溶液呈酸性,故D错误;
故选C.
点评 本题以溶液酸碱性判断为载体考查盐类水解,为高频考点,明确盐类特点“有弱才水解、无弱不水解、谁强谁显性、谁弱谁水解、强强显中性”是解本题关键,知道常见盐溶液酸碱性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 5:3:2 | B. | 5:2:3 | C. | 5:1:2 | D. | 9:6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
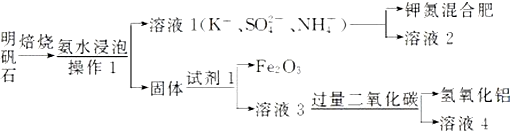
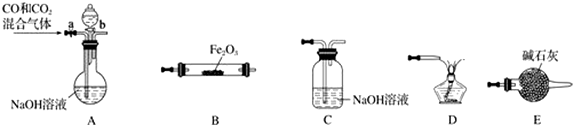
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
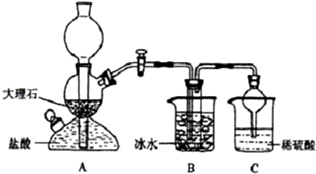
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
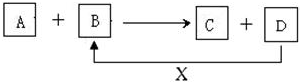
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
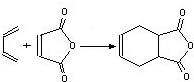
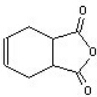 互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种.
互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种. ,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):
,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):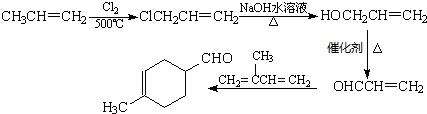 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2溶液 | H2SO4溶液 | CuSO4溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:Cl-<Br-<I- | ||
| C. | 酸性:H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com