
【题目】下列选用的相关仪器、用品不符合实验要求的是( )
A | B | C | D |
准确量取 19.01 mL水 | 新制氯水的保存 | 测定0.1 mol·L-1Na2CO3溶液的pH | 分离水和乙酸乙酯 |
25 mL酸式滴定管 | 带玻璃塞的棕色细口瓶 | 镊子、pH试纸、表面皿 | 分液漏斗、烧杯 |
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
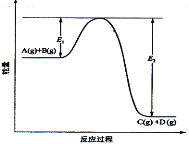
(1)该反应是__________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是__________________;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于气体制备的说法不正确的是( )
A.用碳酸钠粉末可以制备CO2
B.用铁片和稀H2SO4反应制取H2时,为加快产生H2的速率可改用浓H2SO4
C.加热分解NH4HCO3固体,将所得的气体进行适当处理可获得NH3
D.用KMnO4固体和用KClO3固体制备O2的装置完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:

由此可知原溶液中( )
A.原溶液中c(Fe3+)=0.2 mol·L-1
B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1
C.SO42ˉ、NH4+ 、Na+一定存在,CO32ˉ、Al3+一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是

A.反应的化学方程式为:2 M![]() N
N
B.t1时,N的浓度是M浓度的2倍
C.t2时,正逆反应速率相等,达到平衡
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种常见弱酸的电离平衡常数(25 ℃)
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.20×10-13 |
回答下列问题:
(1)当温度升高时,K值________(填“增大”“减小”或“不变)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是________,最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________,产生此规律的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于几类化合物的表述,不正确的是
A.DNA既是原核生物的遗传物质,也是真核生物的遗传物质
B.蛋白质、糖类、脂肪,核酸都能为细胞的生命活动提供能量
C.胆固醇是构成动物细胞膜的重要成分,在人体内还参与血液中脂质的运输
D.性激素能激发并维持动物的笫二性征,其化学本质为脂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com