
【题目】下表是几种常见弱酸的电离平衡常数(25 ℃)
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.20×10-13 |
回答下列问题:
(1)当温度升高时,K值________(填“增大”“减小”或“不变)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是________,最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________,产生此规律的原因是___________。
 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.78g 苯含有C=C双键的数目为3NA
B.1L 1mol·L -1的Na2CO3溶液中含有阴离子的数目大于NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用惰性电极电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示。测得同温同压下,气体甲、乙的体积比约为1∶2,下列说法中正确的是( )

A.a极与电源的负极相连
B.b电极反应式:2H2O-4e-= O2↑+4H+
C.离子交换膜c、d均为阴离子交换膜
D.产物丙为硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选用的相关仪器、用品不符合实验要求的是( )
A | B | C | D |
准确量取 19.01 mL水 | 新制氯水的保存 | 测定0.1 mol·L-1Na2CO3溶液的pH | 分离水和乙酸乙酯 |
25 mL酸式滴定管 | 带玻璃塞的棕色细口瓶 | 镊子、pH试纸、表面皿 | 分液漏斗、烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L
B. 从1L2mol/L的H2SO4溶液中取出0.5L,该溶液溶质物质的量浓度为1mol/L
C. 0.5L2mol·L-1的BaCl2溶液中,Ba2+和Cl-的总数为3×6.02×1023
D. 10g98%的硫酸(密度为1.84g·cm-3)与10mL18.4mol·L-1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。
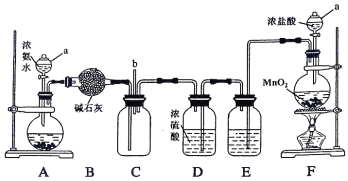
请回答下列问题:
(1)仪器a的名称为 ;装置A的圆底烧瓶中盛放的固体物质可选用___________(填序号)。
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置F的圆底烧瓶中发生反应的离子方程式为 ;装置E的洗气瓶中盛放的试剂为 ,其作用是___________。装置D中浓硫酸的作用是 。
(3)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为空气的主要成分之一,该反应的化学方程式为 。
(4)从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A可以作水果的催熟剂,D是食醋的主要成分。相关的转化关系如下:
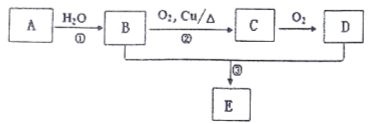
请回答下列问题:
(1)A的结构简式为 ,反应①的反应类型是 。
(2)C的名称是 。
(3)反应③的化学方程式为 ,该反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏伽德罗常数的值。下列说法正确的是
A.该氯原子的相对原子质量为![]()
B.mg该氯原子的物质的量为![]()
C.该氯原子的摩尔质量为aNAg
D.ag该氯原子所含的电子数为17mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是 和 (填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH= kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是 。
②在30 ℃、pH=4.0条件下,O3的分解速率为 mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为 (填字母)。
A.40 ℃、pH=3.0 B.10 ℃、pH=4.0 C.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为 (填“A”或“B”),其电极反应式为 。
②若C处通入O2,则A极的电极反应式为 。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为 。(忽略O3的分解)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com