
| A.SO2和CO2分子中,S和O之间、C和O之间都是共价键 |
| B.同一周期元素的原子半径越小越容易失去电子 |
| C.碱金属元素是指第1A族的所有元素 |
| D.P和As属于第V A族元素,H3 PO4酸性比H3 AsO4的弱 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | I1 | I2 | I3 | I4 |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
| | 单键 | 双键 | 叁键 | |
| AB | 键能(kJ·mol―1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ·mol―1) | 154.8 | 418.4 | 941.7 |
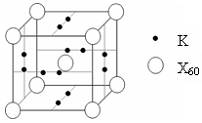
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.电子云表示电子在原子核外运动的轨迹 |
| B.电子云表示电子在核外单位体积的空间出现机会的多少 |
| C.电子云界面图中的小黑点密表示该核外空间的电子多 |
| D.电子云可表示电子在核外运动的方向 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大 |
| B.Y、Z的气态氢化物的热稳定性:YHm>HnZ |
| C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 |
| D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 lH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ.。 计算H2和Br2反应生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。
lH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ.。 计算H2和Br2反应生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com