
| A、Al起始反应的离子方程式为2Al+6H+=2Al3++3H2↑ |
| B、滤液I中一定含有Cu2+、Al3+;一定含有Fe2+和Fe3+中的一种或两种 |
| C、滤渣I的主要成分是Au与Pt,由此可以回收贵重的金属 |
| D、加入稀硫酸可以提高硝酸的利用率,使硝酸根离子完全反应 |


科目:高中化学 来源: 题型:
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
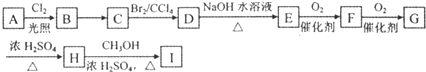
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温下,浓硝酸不可储存在铝制容器中 |
| B、要从铝土矿中提取铝,必须获得较高纯度的氧化铝 |
| C、铝具有良好的抗腐蚀性,说明铝在空气中不易于氧气发生反应 |
| D、Al、Al2O3、AlCl3都既能和稀盐酸反应,又能和氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol NO |
| B、0.3mol NO2 |
| C、0.3molNO 0.3molNO2 |
| D、0.2molNO2 0.2molN2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 在一定条件下可水解为
在一定条件下可水解为 ;则F
;则F查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是| A、铁粉与水蒸气加热 肥皂水冒泡 |
| B、加热NH4Cl和Ca(OH)2混合物 酚酞溶液变红 |
| C、NaHCO3固体受热分解 澄清石灰水变浑浊 |
| D、石蜡油在碎瓷片上受热分解 Br2的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com