
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
(1)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g) △H=-1143 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
则2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=___________kJ·mol-1。
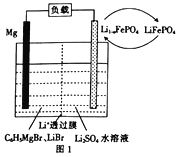
(2)一种镁一锂双离子二次电池的装置如图1所示。
①放电时, Mg 电 极 为___________ (填“ 正极”或“负极” ), Li +迁 移 至___________ (填“正极区”或“负极区”)。
②充电时,阳极的电极反应式为_______________________________。
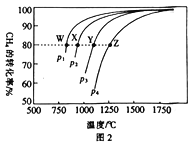
(3)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
①图中p1、p2、p3、p4 代表不同压强,压强最大的是___________。该反应的△H___________(填“>"“<”或“=”下同)0。
②压强为p4时,在Y点:v(正)___________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、k3、K4由大到小的顾序为_____________。
【答案】 -659 负极 正极区 LiFePO4-xe-=Li1-xFePO4+xLi+ p4 > < K4>K3>K2>K1
【解析】(1)①2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g)△H=-1143kJ·mol-1,②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1,根据盖斯定律:①-②得:2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=(-1143kJmol-1)-(-484kJmol-1)=-659kJmol-1,故答案为:-659;
(2)①根据图示,放电时,Mg电极失去电子发生氧化反应,镁为负极;原电池中阳离子向正极移动,则锂离子电池放电时,Li+向正极迁移,故答案为:负极;正极区;
②根据图示可知,充电时,阳极的电极上LiFePO4失电子,电极反应式为:LiFePO4-xe-═xLi++Li1-xFePO4,故答案为:LiFePO4-xe-═xLi++Li1-xFePO4;
(3)①反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),增大压强,平衡逆向移动,甲烷的转化率减小,即压强越大,甲烷的转化率越小,因此p1、p2、p3、p4代表不同压强,压强最大的是p4;根据图像,升高温度,甲烷的转化率增大,说明平衡正向移动,则正反应为吸热反应,△H>0,故答案为:p4;>;
2CO(g)+2H2(g),增大压强,平衡逆向移动,甲烷的转化率减小,即压强越大,甲烷的转化率越小,因此p1、p2、p3、p4代表不同压强,压强最大的是p4;根据图像,升高温度,甲烷的转化率增大,说明平衡正向移动,则正反应为吸热反应,△H>0,故答案为:p4;>;
②压强为p4时,Y点不是平衡状态,要达到平衡状态,反应需要逆向进行,因此v(正)<v(逆) ,故答案为:<;
③该反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,因此图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顾序为K4>K3>K2>K1,故答案为:K4>K3>K2>K1。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于焰色反应的说法正确的是
A.焰色反应一定属于化学变化
B.观察K2SO4的焰色应透过蓝色的钴玻璃
C.可以用焰色反应鉴别Na与NaCl
D.NaCl与KCl在灼烧时火焰颜色相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离子方程式错误的是
A.NaHCO3=Na++HCO3-B.NaHSO4=Na++H++SO42-
C.KClO3=K++Cl-+3O2-D.H2SO4=2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. NH3、O2、NO、H2O(g)同时存在时,则反应达到化学平衡状态
B. 单位时间内生成x mol NO,同时消耗x mol NH3时,说明反应达到化学平衡状态
C. 达到化学平衡状态时,若增大容器体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系是3v正(NH3)=2v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如图所示。下列说法正确的是( )
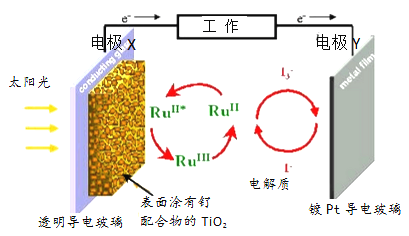
A. 镀铂导电玻璃的作用是传递I-
B. 电池工作时,光能转变为电能,X 为电池的正极
C. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
D. 电池的电解质溶液中I-和I3-的浓度均不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温高压下碳氧化物具有极高的化学活性,能与多种单质或化合物反应。
(1)一定条件下,CO与H2 可合成甲烷,反应方程式为:CO(g)+3H2(g) ![]() CH4(g)+ H2O(g)
CH4(g)+ H2O(g)
①一定条件下,该反应能够自发进行的原因是_________
②已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8kJ/mol 283.0kJ/mol和890.0kJ/mol。
写出CO 与H2 反应生成CH4 和CO2 的热化学方程式:_____________。
(2)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
反应Ⅱ: CO2 (g) +3H2 (g) ![]() CH3OH (g) +H2O (g)
CH3OH (g) +H2O (g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为______________。
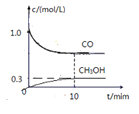
②一定温度下,在体积可变的密闭容器中加入4molH2和一定量的CO发生反应Ⅰ,开始时容器体积为2L,CO 和CH3OH (g) 的浓度随时可变化如图。10min 达到平衡,则反应1的化学平衡常数为____________。
③恒温恒容条件下,在密闭容器中等物质的量的通入CO2 和H2, 下列描述能说明反应Ⅱ已经达到平衡状态的是___。(填标号)
A.容器内CO2的体积分数不再变化
B.当CO2和H2转化率的比值不再变化
C.单位时间CH3OH分子断裂5NA个共价键,同时断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量为34.5,且保持不变
(3)甲烷碱性燃料电池装置如图所示(开始时两边溶液质量相等),用电器为惰性电极电解装置,其原理是:通电后,将Co2+氧化成Co3+,进而彻底氧化CN-为无害气体使废水得以净化。
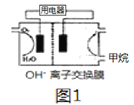
①当除去1molCN-时,图1两边质量差为__________g.
②负极电极反应式为__________.
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH=-29.1KJ/mol,科研人员对该反应进行了研究.部分研究结果如下:
HCOOCH3(g) ΔH=-29.1KJ/mol,科研人员对该反应进行了研究.部分研究结果如下:
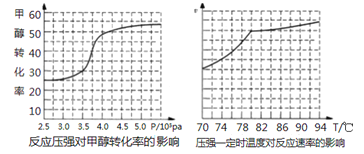
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是_____。
②实际工业生产中采用的温度是80℃,其理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知环己烯可以通过丁二烯与乙烯发生环化加成反应得到. 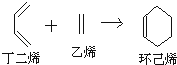 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.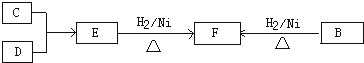
(1)写出B→F的化学方程式:
(2)满足条件的E的结构简式可能为 或
(3)满足条件的C的名称可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Mn2+的酸性溶液中滴加过二硫酸钾(K2S2O8)溶液,会发生如下反应(未配平):Mn2++S2O![]() +H2O→MnO
+H2O→MnO![]() +SO
+SO![]() +H+。下列说法正确的是( )
+H+。下列说法正确的是( )
A. 反应后溶液的pH降低 B. 该反应中起氧化作用的是Mn2+
C. 反应中有1 mol还原剂参加反应,则转移的电子为4 mol D. 该反应常用于检验溶液中Mn2+的存在,现象是溶液紫红色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物fingolimod的盐酸盐是一种口服免疫抑制剂,可用于治疗多发性硬化症.其合成的路线流程如下: 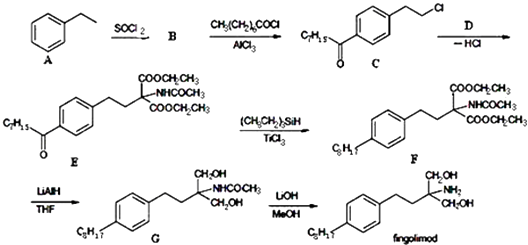
(1)A→B的反应类型是 , D的结构简式 .
(2)化合物fingolimod中含氧官能团的名称:
(3)写出B→C的化学反应式: .
(4)合成过程中,(CH3CH2)3SiH和LiAlH4的作用都是做剂.
(5)B水解产物有多种同分异构体,写出符合下列条件的B水解产物的一种同分异构体的结构简式 .
①遇FeCl3溶液发生显色反应 ②分子中有4中化学环境不同的氢原子
③苯环上一溴代物有2种
(6)已知2RCOOH+SOCl2→2RCOCl+H2O+SO2↑.现以甲苯、苯甲酸和 ![]() 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: 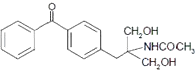 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com